| 目前见过最详细的人和小鼠的DC分类、功能介绍和标记列表 | 您所在的位置:网站首页 › marker标记的是啥 › 目前见过最详细的人和小鼠的DC分类、功能介绍和标记列表 |
目前见过最详细的人和小鼠的DC分类、功能介绍和标记列表
|
经典DC(cDC):具有较短的半衰期并且不断被来源于骨髓的前体取代。 cDC来源于来源于共同DC祖细胞分化而成的pre-cDC,依赖于Flt3-L。 转录组分析显示cDC具有特异性的分子标记,将其与pDC和其他髓样细胞群体区分开来,特别是转录因子zbtb46,特异性表达于cDC。 cDC是真正来源于造血系统的细胞。cDC可以进一步分成两个发育不同的亚群:Batf3依赖性和IRF4依赖性DC。 Batf3依赖性DC:包含驻留CD8 + DC和迁移CD103 + langerin + DC。 这些亚群拥有共同的个体发育和分子标记,包括XCR1和TLR3的特异性表达。 它们的发育依赖于转录因子IRF8和Batf3 。 Batf3依赖性DC专门通过其内吞途径交叉递呈病原体来源或肿瘤抗原。 IRF4依赖性DC:包含驻留的CD8-CD11b + DC和迁移的CD11b + DC。 它们的发育依赖于转录因子RelB和IRF4 。 IRF4依赖性DCs专门用于MHC II限制性抗原递呈。 在变应原攻击或病原体感染后,IRF4依赖性DC在引流淋巴结中诱导Th17或Th2应答。 朗罕氏细胞:存在于皮肤表皮以及口腔、阴道粘膜中。 它们在个体发育上与其他迁移DC有显著不同。 朗格汉斯细胞是自我更新的,并且源自胚胎单核细胞,在出生前便定植于组织中。 它们的发展依赖于CD115 / MCSF-R及其配体IL-34 。 由于这些特点,朗格汉斯细胞被认为是巨噬细胞类。 尽管如此,朗格汉斯细胞呈现出DC的一些功能特征。 朗罕氏细胞能够迁移到淋巴结并将抗原呈递给CD4+T细胞。 在白色念珠菌感染的情况下,朗罕氏细胞对诱导Th17应答至关重要。 用模型抗原进行表皮免疫后,朗格汉斯细胞诱导Th2应答。不过,朗罕氏细胞不会在体内交叉呈递抗原。 单核来源DC:在病原体诱导或无菌炎症过程中,募集到炎症部位的单核细胞可以原位分化成表达DC标志物(CD11c和MHC II类)的细胞并显示DC的一些功能特征(迁移到淋巴结和抗原呈递功能),因此这些细胞被鉴定为DC,通常被称为“炎性DC”。他们的发育依赖于CD115 / MCSF-R。在缺乏炎症的情况下,在外周组织中也可以发现单核细胞来源的DC,例如肠道、肌肉或皮肤。因为它们不是来源于常见的DC祖细胞,最近提出将单核细胞衍生的DC分类为单独的系列,与pDC和cDC区分开来。值得注意的是,单核细胞来源的DC已被证明表达转录因子zbtb46。 “炎性DC”可以进行交叉表达和MHC II类限制性表达,并且可以根据炎症环境诱导Th1、Th2或Th17应答[45]。在疫苗接种环境中,“炎性DC”促进T滤泡辅助分化。然而,最近的研究表明,“炎症性DC”的主要作用是直接在组织中刺激抗原特异性T细胞(效应T细胞或记忆T细胞)的产生,而不是在淋巴结中。 人DC分类、功能及其表型
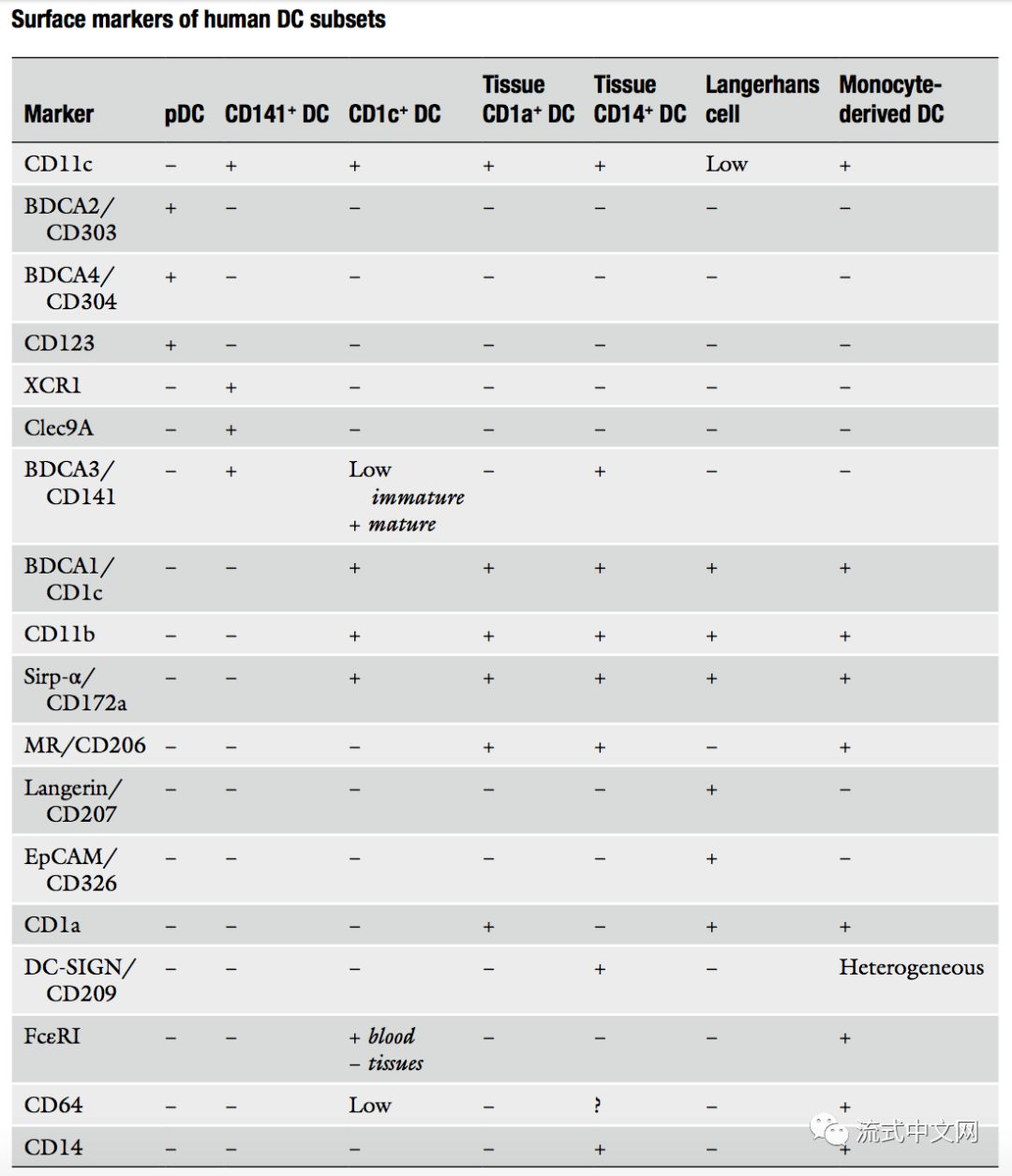
pDC:人pDC的发育可能取决于Flt3-L,因为向健康志愿者注射Flt3-L会增加循环pDC的数量。 转录因子E2-2对于pDC发育是必不可少的。 和小鼠pDC一样,人类pDCs也专门分泌I型干扰素, 但是,人类pDC也向T细胞呈递抗原。 根据它们接受的激活信号,pDC可诱导Th1极化或调节性T细胞分化。 多项研究表明,人类pDC可高效交叉呈递抗原,无论是可溶性、病毒还是细胞相关抗原。 然而,pDC不能交叉呈递坏死的细胞衍生抗原。 cDC:最初的研究认为人类cDC存在于血液、脾脏、扁桃体和淋巴结中,曾被分为两个亚群:BDCA1/CD1c + DC和BDCA3/CD141 + DC。后来在肺、肝和肠中也发现了具有相似表型的DC群体,在皮肤中也发现CD141 + DC 。 cDC的发育似乎也依赖于Flt3-L,因为向健康志愿者注射Flt3-L会增加cDC数。在人cDC中,也特异性表达转录因子zbtb46。比较转录组分析表明,CD141 + DC与小鼠Batf3依赖性DCs同源,而CD1c + DCs与小鼠IRF4依赖性DCs同源。另外,一些表型标记在小鼠和人DC亚群之间保守(见上表)。体外实验表明CD141 + DC的发育依赖于Batf3。然而,其他转录因子可能与小鼠不同,因为IRF8突变患者同时缺乏两类cDC。稳态淋巴结中CD1c +和CD141 + DC可诱导Th1和Th2极化,当被烟曲霉激活时,肺CD1c + DCs能有效诱导Th17应答。 CD1a + 和CD14 +组织DC:在皮肤和阴道粘膜中存在CD1a + DC和CD14 + DC。 他们的系列来源以及与其他DC亚群的关系仍不清楚。 有人认为皮肤CD1a + DC是CD1c + cDC迁移过来。 功能分析表明,皮肤CD14 + DCs可有效诱导滤泡辅助T细胞。 粘膜CD14 + DC也可诱导Th1极化。皮肤CD1a + DC优先诱导Th2极化,并能够交叉呈递抗原。 郎罕氏细胞:与小鼠朗罕氏细胞相似,人郎罕氏细胞也存在于皮肤表皮和粘膜组织中。 人郎罕氏细胞与DC和单核细胞不属于同一系列,因为GATA2突变的患者保留了正常数量的表皮朗罕氏细胞,但缺乏血单核细胞和所有DC亚群。朗罕氏细胞能有效激活CD4+ T细胞并诱导Th2极化。 皮肤朗罕氏细胞也可以进行交叉呈递并有效地诱导效应细胞毒性CD8 T细胞。 单核来源DC:与小鼠单核来源DC一样,此类DC在人类中也被称为”炎性DC“。目前已经在银屑病、特应性皮炎、类风湿性关节炎和肿瘤腹水中发现此类DC。 来自肿瘤腹水的“炎症性DC”转录组学表明,它们来自单核细胞而不是来自DC前体。 值得注意的是,“炎性DC”表达转录因子zbtb46。 此外,转录组分析表明,真皮CD14 + DC和肠CD103 - CD172a + DC与单核细胞有关,可能是稳态单核细胞来源的DC。 关于这些单核细胞来源的DC的功能的数据是有限的。 来自肿瘤腹水和类风湿性关节炎滑膜液的“炎症性DC”可刺激幼稚CD4 T细胞并诱导Th17极化。 原先,我对DC也只停留在很简单的分类层次,编译完这篇之后,瞬间发现,DC家族也如此多能,免疫系统各类细胞之间的关系,跟人类血缘关系的复杂程度有的一拼。 参考文献:Elodie Segura, Nobuyuki Onai. Dendritic Cell Protocols. 第3页-第9页。 本文来自流式中文网(flowcyto.cn)欢迎转发到朋友圈,但谢绝复制粘贴转载如有需要请联系[email protected]返回搜狐,查看更多 |
【本文地址】