| 谷胱甘肽在肿瘤细胞发生铁死亡过程中的作用研究 | 您所在的位置:网站首页 › gsh币 › 谷胱甘肽在肿瘤细胞发生铁死亡过程中的作用研究 |
谷胱甘肽在肿瘤细胞发生铁死亡过程中的作用研究
|
文献综述
Open Access
Copyright
©The Author(s) 2021. Published by Baishideng Publishing Group Inc. All rights reserved.
世界华人消化杂志. 2021-08-08; 29(15): 901-907
在线出版日期: 2021-08-08. doi: 10.11569/wcjd.v29.i15.901
谷胱甘肽在肿瘤细胞发生铁死亡过程中的作用研究
杨凤娟, 谭宁, 张天禹, 程潭
杨凤娟, 程潭, 桂林医学院基础医学院人体解剖学教研室 广西壮族自治区桂林市 541199杨凤娟, 研究方向为肿瘤代谢.谭宁, 桂林医学院科学实验中心 桂林医学院基础医学院人体解剖学教研室 广西壮族自治区桂林市 541199张天禹, 桂林医学院附属医院泌尿外科 广西壮族自治区桂林市 541004
ORCID number: 杨凤娟 (0000-0001-8495-7683); 程潭 (0000-0003-4813-1280).
基金项目: 国家自然科学基金地区基金项目, No. 81360326、81360377; 广西自然科学基金重点项目, No. 2015GXNSFDA139027.作者贡献分布: 本文综述由杨凤娟、张天禹以及谭宁完成; 程潭审校.
通讯作者: 程潭, 主治医师, 541199, 广西壮族自治区桂林市, 桂林医学院基础医学院人体解剖学教研室. [email protected]
收稿日期: 2021-04-09修回日期: 2021-05-18接受日期: 2021-06-18在线出版日期: 2021-08-08
铁死亡是近年发现的一种铁依赖性脂质过氧化和活性氧(reactive oxygen species, ROS)诱导的调节性细胞死亡, 其发生过程中伴有ROS水平升高和抗氧化系统的下降--如酶抗氧化剂中谷胱甘肽过氧化物酶和非酶抗氧化剂中谷胱甘肽等. 谷胱甘肽是细胞内普遍存在的低分子量抗氧化剂, 其稳态水平依赖于所需氨基酸前体吸收速率、酶活性、谷胱甘肽二硫化物的回收以及氧化还原之间的平衡等. 目前, 靶向谷胱甘肽代谢已被广泛研究用于癌症治疗, 与组合疗法相比, 作为单一治疗策略的谷胱甘肽耗竭产生了显著的治疗效果. 因此, 深入认识谷胱甘肽在铁死亡发生过程中的作用, 将为癌症治疗提供新的思路和方向. 关键词: 铁死亡; 活性氧; 谷胱甘肽过氧化物酶; 谷胱甘肽核心提要: 谷胱甘肽(glutathione, GSH)作为一种生物体内重要的抗氧化剂, 其靶向代谢也已被广泛研究用于癌症治疗, 进一步明确GSH在肿瘤细胞发生铁凋亡过程中的作用, 以其代谢的各个步骤为靶点制定具体的治疗策略, 将为肿瘤的治疗提供新的思路和方向. 引文著录: 杨凤娟, 谭宁, 张天禹, 程潭. 谷胱甘肽在肿瘤细胞发生铁死亡过程中的作用研究. 世界华人消化杂志 2021; 29(15): 901-907 Role of glutathione in ferroptosis of tumor cells Feng-Juan Yang, Ning Tan, Tian-Yu Zhang, Tan Cheng Feng-Juan Yang, Tan Cheng, Department of Human Anatomy, Basic Medical College, Guilin Medical University, Guilin 541199, Guangxi Zhuang Autonomous Region, ChinaNing Tan, Scientific Experiment Center, Department of Human Anatomy, Basic Medical College Guilin Medical University, Guilin 541199, Guangxi Zhuang Autonomous Region, ChinaTian-Yu Zhang, Department of Urology, the Affiliated Hospital, Guilin Medical University, Guilin 541004, Guangxi Zhuang Autonomous Region, China Supported by: Regional Fund Project of National Natural Science Foundation of China, No. 81360326 and No. 81360377; Key Projects of Guangxi Natural Science Foundation, No. 2015GXNSFDA139027. Corresponding author: Tan Cheng, PhD, Attending Physician, Department of Human Anatomy, Basic Medical College, Guilin Medical University, Guilin 541199, Guangxi Zhuang Autonomous Region, China. [email protected] Received: April 9, 2021Revised: May 18, 2021Accepted: June 18, 2021Published online: August 8, 2021Ferroptosis is a type of iron-dependent lipid peroxidation and reactive oxygen species (ROS)-induced regulatory cell death discovered in recent years, which is accompanied by the increase of ROS level and the decrease of antioxidant system components, such as glutathione peroxidase in enzyme antioxidants and glutathione in non-enzyme antioxidants. Glutathione (GSH) is the predominant low-molecular-weight antioxidant with a ubiquitous distribution inside the cell, and its steady-state level depends on the absorption rate of amino acid precursors, enzyme activity, recovery of glutathione disulfide, and the balance between oxidation and reduction. At present, targeted glutathione metabolism has been used in cancer treatment widely. Compared with combination therapy, GSH depletion as a single treatment strategy has a significant effect. Therefore, further understanding of the role of GSH in ferroptosis will provide new ideas and directions for cancer treatment. Key Words: Ferroptosis; Reactive oxygen species; Glutathione peroxidase; Glutathione Citation: Yang FJ, Tan N, Zhang TY, Cheng T. Role of glutathione in ferroptosis of tumor cells. Shijie Huaren Xiaohua Zazhi 2021; 29(15): 901-907 URL: https://www.wjgnet.com/1009-3079/full/v29/i15/901.htm DOI: https://dx.doi.org/10.11569/wcjd.v29.i15.901 0 引言2003年, Dolma等[1]发现一种名为Erastin的新化合物, 其可能导致基因RAS突变的肿瘤细胞以不同于传统细胞凋亡的方式死亡. 2008年, Yang等[2]发现了RSL3和RSL5两种与Erastin具有相同作用的新化合物, 并确定这种新的细胞死亡可被铁螯合剂、去铁胺B甲烷磺酸盐和捕获过氧自由基的抗氧化剂维生素E所抑制, 证实这种形式的细胞死亡与细胞内铁和活性氧有关. 2012年, Stockwell实验室将由依赖于铁和脂质活性氧积累引起的细胞死亡类型命名为铁死亡[3]. 根据该实验室最初的研究, 铁死亡在形态学、生化和遗传水平上明显不同于其他类型的调节性细胞死亡, 如凋亡、坏死和自噬等, 铁死亡的形态学特征是特异性的线粒体皱缩、膜密度增加、线粒体嵴减少或消失[3]; 细胞在发生铁死亡的同时还会释放信号分子(如HMGB1), 从而引起炎症反应; 铁死亡的生化特征主要有: (1)铁和活性氧的积累; (2)抑制胱氨酸谷氨酸逆向转运体(System Xc-)降低胱氨酸摄取、谷胱甘肽(glutathione, GSH)耗竭与NADPH氧化增加; (3)MAPKs系统的激活等[2], 其中GSH耗竭在铁死亡的发生过程中起着至关重要的作用. GSH化学名为三肽γ-L-谷氨酰-L-胱氨酰甘氨酸, 是人体内最丰富的内源性抗氧化剂, 约90%的GSH储存于细胞胞浆中, 其余10%位于线粒体、细胞核和内质网中[4]. GSH主要以三种形式存在, 分别为还原型GSH、谷胱甘肽二硫化物(glutathione disulphide, GSSG)和谷胱甘肽蛋白混合二硫化物. 生理情况下, 还原型GSH比氧化型GSH即GSSG丰富10-100倍, GSH/GSSG氧化还原偶联不仅决定生物系统中的氧化还原状态, 还有许多其他功能, 如影响细胞周期进程、细胞死亡、转录因子活性等[5]. 在这篇综述中, 我们主要讨论了GSH的稳态调控, GSH在铁死亡发生过程中的作用, 以及以GSH为靶点诱导肿瘤细胞发生铁死亡, 为肿瘤的治疗提供一种新思路. 1 铁死亡的调控机制胞膜脂上的多聚不饱和脂肪酸(polyunsaturated fatty acid, PUFA)链易被活性氧(reactive oxygen species, ROS)氧化, 形成脂质过氧化物, 在铁离子的介导下, 脂质过氧化物转变成有毒的脂质自由基(LO-), 导致细胞膜脂的多聚不饱和脂肪酸破碎[1], 引发细胞死亡. 铁死亡主要受铁代谢途径、System Xc-/GPX4途径和脂质代谢途径的共同调控. 1.1 铁代谢途径的调节铁对几乎所有生物的生存都是必不可少的, 因为它是一系列生化过程的辅助因子, 包括氧气储存、氧化磷酸化和细胞增殖所需的酶反应, 铁也是脂质过氧化物的积累和铁死亡的发生所必需的元素之一[6]. 因此, 铁的输入、排出、储存和流通量都会影响铁死亡的发生. 当胞质中存在过量游离亚铁离子(Fe2+)时, 大量聚集的Fe2+具有极强的氧化性, Fe2+容易与H2O2发生Fenton反应产生ROS而导致脂质过氧化和铁死亡的发生[6]. 循环铁以Fe3+依附在转铁蛋白的形式存在, Fe3+通过膜上的转铁蛋白受体1 (transferrin receptor 1, TFR1)进入细胞, 然后定位于细胞内. 在核内体中, 铁还原酶将Fe3+还原为Fe2+. 最后, 二价金属转运体1 (Divalent metal transporter 1, DMT1, 也称为SLC11A2)介导铁离子从核内体释放到不稳定的细胞质铁池中, 多余的铁储存在铁蛋白轻链多肽(ferritin light chain, FTL)与铁蛋白重链多肽1 (ferritin heavy chain 1, FTH1)组成的铁储存蛋白复合物中. 铁离子的出膜是由膜蛋白铁(也叫铁射流泵, 也称为SLC11A3)激动的, 其能将Fe2+氧化成Fe3+. 病理状态下, 通过研究铁死亡经典诱导剂Erastin作用于人类癌细胞, 热休克预处理和过表达热休克蛋白B1可抑制TFR1表达, 蛋白激酶C介导的铁代谢主要转录因子铁反应元件结合蛋白2被抑制, 显著增加FTL与FTH1表达, 降低细胞内亚铁离子浓度和脂质活性氧的产生; 而血红素氧合酶-1能够通过补充细胞内铁离子及产生活性氧, 加速Erastin诱导的铁死亡[7]. 这表明, 铁蛋白调控和铁代谢稳态可能成为铁死亡机制的重要调节点. 1.2 System Xc-/GPX4通路调节科学研究表明胱氨酸谷氨酸逆向转运体System Xc-/GPX4通路是铁死亡主要的发生途径之一[2], 其中System Xc-对谷胱甘肽的合成至关重要. System Xc-是由机体细胞膜上SLC7A11和SLC3A2两个亚基组成的重要抗氧化体系, 可按1:1比例将细胞外胱氨酸摄取入胞内, 将谷氨酸排出至胞外, 胱氨酸进入细胞后被迅速还原成半胱氨酸, 参与胞内重要自由基清除剂GSH的合成[8]. 谷胱甘肽过氧化物酶(glutathione peroxidase, GPXs)家族有许多成员, 包括 GPX1-GPX8, 其中GPX4在铁死亡中扮演着更加重要的角色. GPX4作为哺乳动物中修复脂质细胞氧化损伤的硒蛋白, 通过将底物GSH转化为GSSG的同时将细胞内毒性脂质过氧化物还原为无毒脂醇醇(L-OH)或将游离的H2O2转化为水, 保护细胞膜结构及功能不受过氧化物的干扰及损害[9]. 研究发现[8]p53可通过下调SLC7A11的表达从而抑制System Xc-吸收胱氨酸, 导致谷胱甘肽合成障碍, 谷胱甘肽又是GPXs发挥作用的必要辅助因子, 谷胱甘肽合成障碍将导致GPXs活性降低, 细胞抗过氧化能力降低, 脂质活性氧堆积, 引起细胞发生铁死亡; Erastin[7]、柳氮磺胺吡啶[8]等都是通过作用于System Xc-诱导细胞发生铁死亡. RSL3与Erastin都是铁死亡诱导剂, 两者均能引起脂质活性氧的上升, 但与Erastin的作用方式不同的是, RSL3能够直接抑制GPX4活性, 致细胞抗氧化能力下降, 脂质活性氧上升, 最终引起铁死亡[8]. 1.3 脂质代谢途径调控细胞膜或细胞器膜, 由于其富含多不饱和脂肪酸, 特别容易受到ROS损伤, 称为"脂质过氧化", 脂质过氧化也是铁死亡发生所必须的元素之一. 脂氧合酶的活性可以催化含有PUFA的磷脂发生过氧化反应, 促进铁死亡发生. 基于CRISPR的遗传筛选确定了两种脂质代谢调节剂, 溶血磷脂酰胆碱酰基转移酶3 (LPCAT3)和酰基辅酶A合成酶长链家族成员4 (ACSL4), 它们促进由GPX4抑制诱导的KBM7细胞发生铁死亡; 应用脂质组学研究, 含有花生四烯酸(C20:4)或其延长产物肾上腺酸(C22:4)的磷脂酰乙醇胺(PE)是脂质氧化作用并驱使细胞朝向铁死亡发生的关键磷脂, 而ACSL4和LPCAT3参与多不饱和脂肪酸的生物合成和重塑, 通过补充花生四烯酸或其他多不饱和脂肪酸的细胞表现出对铁死亡的高灵敏, 执行铁死亡发生的重要步骤[10]. 研究人员Doll和Bersuker等[11,12]发现线粒体凋亡诱导因子2能与脂质过氧化自由基清除剂-辅酶Q10协同作用抑制细胞铁死亡, 并将其更名为铁死亡抑制蛋白1 (ferroptosis-suppressor-protein 1, FSP1). 基于此, 研究发现[11]iF-SP1可在过表达FSP1的GPX4基因缺失细胞系中抑制FSP1活性并促进脂质过氧化反应对细胞造成损伤(表1). 经典的自由基清除剂他汀类药物-Ferrostatin以及脂质过氧化酶抑制剂-脂溶性抗氧化剂维生素E (Vitamin E)等均能通过影响脂质氧化过程实现对细胞发生铁死亡的调控[3,13]. 表1总结显示了与铁死亡调控相关的作用物质及作用靶点. 表1 与铁死亡调控相关的作用物质及作用靶点. 调控途径作用物质作用靶点调控效应参考文献铁代谢途径HSPB1抑制TFRI抑制胞内铁, 抑制铁死亡[7]蛋白激酶C抑制IREB2增加FTL、FTH1表达, 抑制铁死亡血红素氧合酶-1分解血红素补充胞内铁, 诱导铁死亡System Xc-/GPX4通路P53、Erastin、柳氮磺胺吡啶抑制SLC7A11GSH合成障碍, 诱导铁死亡[7,8]RSL3抑制GPX4诱导铁死亡脂质代谢途径i-FSP1抑制FSP1[11]Ferrostatin抑制ROS抑制铁死亡[3,13]Vitamin E抑制OH HSPB1: 热休克预处理和过表达热休克蛋白B1; FSP1: 铁死亡抑制蛋白1; ROS: 活性氧. 2 谷胱甘肽代谢平衡与铁死亡在铁死亡涉及的System Xc-/GPX4通路中, System Xc-是参与GSH合成的重要转运体, GPX4通过催化GSH转化为GSSG发挥抗氧化作用, GSH处于该通路的中心. GSH作为体内重要的抗氧化剂, 可以清除ROS和活性氮, 也可以用作解毒剂发挥整合解毒作用. 一般内源性抗氧化系统包括: (1)酶抗氧化剂, 如超氧化物歧化酶、过氧化氢酶、谷胱甘肽过氧化物酶和硫氧还蛋白; 和(2)非酶抗氧化剂, 包括GSH、维生素或其类似物(维生素A、C和E; 辅酶Q10; 和类黄酮)、矿物质(硒和锌), 以及代谢产物(胆红素和褪黑素)等[14]. 作为消除活性氧的非酶系抗氧化体系, 谷胱甘肽的代谢平衡与铁死亡的发生关系密切.谷胱甘肽的合成是由半胱氨酸、谷氨酸和甘氨酸在胞浆中通过两种ATP依赖的酶反应进行的. 第一步(也是限制性的一步)是半胱氨酸与谷氨酸结合形成γ-谷氨酰半胱氨酸, 该反应由γ-谷氨酰半胱氨酸连接酶(GCL)催化. 在第二个反应中, 谷胱甘肽合成酶(glutathione synthetase, GSS)将甘氨酸添加到γ-谷氨酰半胱氨酸中并产生GSH. 半胱氨酸残基是GSH发挥还原作用的主要结构. 半胱氨酸残基的存在使得GSH被非酶自由基或ROS/RNs氧化为GSSG, 并由属于谷胱甘肽过氧化物酶家族的酶进行酶促氧化. GSSG的积累对细胞具有潜在的毒性, 因为它起着助氧化剂的作用, 与烟酰胺腺嘌呤二核苷酸磷酸(NADP/NADPH)和硫氧还蛋白(Trx(SH)2/TrxSS)系统一起, GSH/GSSG氧化还原偶决定了生物系统的氧化还原状态[5], GSSG通过谷胱甘肽还原酶(glutathione reductase, GR)迅速还原成GSH, 这一步需要由NADPH提供H+, 而NADPH主要由戊糖磷酸途径(PPP)的氧化支链产生[5,15]. γ-谷氨酰转移酶(glutamyltransferase, GGT)是一种膜结合酶, 催化细胞外GSH的降解, 有利于合成细胞内GSH所需的组分谷氨酸和半胱氨酸. 该途径又称γ-谷氨酰循环, 是从头生物合成途径的一种替代途径, 在维持细胞内GSH和半胱氨酸方面起着重要作用. 特异性转运体可以将GSH降解产生的所有氨基酸带回细胞内(图1). 特别是System Xc-对于胱氨酸的摄取、半胱氨酸的氧化形式和用于GSH从头合成的限速底物是必不可少[8]. 最近, 已有新的酶已被证明在细胞质中降解GSH, 扩大GSH周转的复杂性[15]. 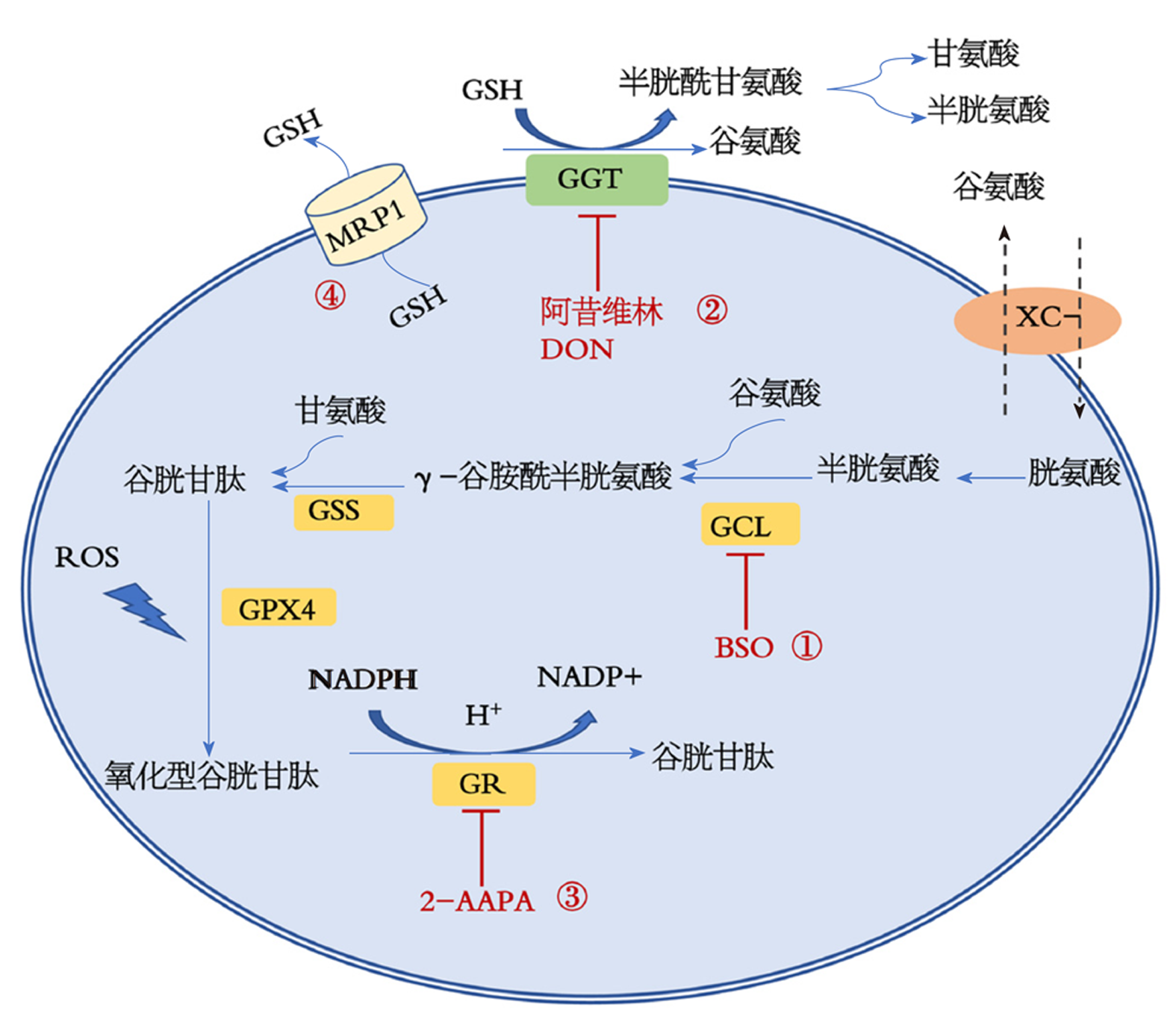 图1 谷胱甘肽(glutathione, GSH)的代谢以及GSH稳态调控在肿瘤治疗中的应用[4].
胱氨酸经System Xc-入胞后, 与谷氨酸及甘氨酸经过两步限制性反应生成GSH; GSH在GPX4的作用下生成谷胱甘肽二硫化物(glutathione disulphide, GSSG); GSSG在谷胱甘肽还原酶以及NADPH提供的H+介导下转化为GSH. MRP1及GGT介导GSH的出胞及分解. 图中也显示了通过药物作用于GSH代谢的不同步骤, 研究GSH稳态调控在肿瘤治疗中的应用. GSH: 谷胱甘肽; MRP1: 多药耐药蛋白1; ROS: 活性氧; GCL: γ-谷胺酰半胱氨酸连接酶; GSS: 谷胱甘肽合成酶GGT: γ-谷胺酰转肽酶; GR: 谷胱甘肽还原酶; GPX4: GSH过氧化物酶4; GSSG: 氧化型谷胱甘肽. (1): 抑制GSH合成; (2): 降低GSH前体可用性; (3): 增加GSSG水平; (4): 促进GSH外排.
图1 谷胱甘肽(glutathione, GSH)的代谢以及GSH稳态调控在肿瘤治疗中的应用[4].
胱氨酸经System Xc-入胞后, 与谷氨酸及甘氨酸经过两步限制性反应生成GSH; GSH在GPX4的作用下生成谷胱甘肽二硫化物(glutathione disulphide, GSSG); GSSG在谷胱甘肽还原酶以及NADPH提供的H+介导下转化为GSH. MRP1及GGT介导GSH的出胞及分解. 图中也显示了通过药物作用于GSH代谢的不同步骤, 研究GSH稳态调控在肿瘤治疗中的应用. GSH: 谷胱甘肽; MRP1: 多药耐药蛋白1; ROS: 活性氧; GCL: γ-谷胺酰半胱氨酸连接酶; GSS: 谷胱甘肽合成酶GGT: γ-谷胺酰转肽酶; GR: 谷胱甘肽还原酶; GPX4: GSH过氧化物酶4; GSSG: 氧化型谷胱甘肽. (1): 抑制GSH合成; (2): 降低GSH前体可用性; (3): 增加GSSG水平; (4): 促进GSH外排.
适度的ROS水平可以通过激活信号通路来支持生存和增殖, 从而在应激性肿瘤微环境中促进肿瘤生长, 然而过量的ROS积累、适当的清除机制的失效或抗氧化剂的缺乏都会导致生物分子的严重损伤, 从而引发细胞死亡[16]. 过量的ROS能够与富含PUFA的质膜发生反应, 在铁离子的介导下生成有毒性的脂质自由基, 诱导质膜破碎, 发生铁死亡. 由于ROS对肿瘤细胞起双重作用, GSH对氧化应激和癌症的发生和发展的影响也很复杂. 它在致癌物的清除和解毒中起着至关重要的作用[4], 而这一途径的改变可以对细胞存活产生深远影响, 另一方面, 研究表明[16]肿瘤细胞中GSH水平的升高能够及时清除过多的ROS, 避免细胞发生铁死亡, 保护骨髓癌、乳腺癌以及结肠癌细胞等, 使它们对几种化疗药物产生耐药性并促进肿瘤细胞发生远处转移. 3 癌症中的谷胱甘肽代谢调控由于线粒体功能紊乱、代谢改变和频繁的基因突变, 癌细胞中ROS的产生显著增加, 导致大量氧化蛋白、DNA损伤和脂质的积累. 因此, 作为一种适应性反应, 癌细胞体内GSH水平也随之升高. GSH稳态取决于GSH合成限速酶活性、前体氨基酸吸收速率以及GSH/GSSG稳态平衡等. NRF2是细胞对抗应激反应的关键调节器. 在细胞核中, NRF2与其它蛋白结合后能够促进靶抗氧化基因的转录, 其中包括GCL. GCL是一种由73kd催化亚基(GCLc)和31kd调节亚基(GCLm)组成的异二聚体[4]. GCLm空突变体小鼠细胞中GSH含量 |
【本文地址】
| 今日新闻 |
| 推荐新闻 |
| 专题文章 |