| 凝血、抗凝及炎性反应 | 您所在的位置:网站首页 › ecmo使用注意事项 › 凝血、抗凝及炎性反应 |
凝血、抗凝及炎性反应
|
UFH涂层的CPB管路激活凝血系统程度低,防止血小板黏附和激活,保持血小板数量 [2-6] 。 7.2.2 组织因子和凝血酶生成 单独通过物质依赖性凝血活化途径生成的凝血酶比CPB过程中少得多 [7-9] 。事实上,凝血酶生成最强大的触发因素是组织因子(TF)。可溶性组织因子由受损的内皮表面释放,在外科手术中这一过程被剧烈放大。此外,与心外膜、心肌、血管外膜和骨骼细胞结合的TF亦被释放。在体外循环心脏直视手术中,纵隔腔的出血富含TF。这部分血液再次进入体循环是凝血酶生成的主要因素 [10-12] 。最近关于凝血系统激活机制认为,随着组织因子释放而形成少量的凝血酶(启动)后,凝血酶通过蛋白酶激活受体(PAR)激活血小板(放大),进而大量的凝血酶在血小板表面形成(级联),最终导致纤维蛋白原转化为纤维蛋白(单体),并借助凝血因子ⅩⅢ形成稳定的纤维蛋白多聚体 [13] 。凝血酶一经形成,它作为一个最强大的血小板活化剂,导致血小板消耗和功能的丧失。 不同于心脏手术,在ECMO中由于缺乏持续供给的可溶性和细胞结合性TF,故该连锁反应受到限制。因此,凝血酶生成虽然存在但是数量很有限。此外,仍有ECMO中凝血酶生成的其他不同观点。 尽管凝血酶的急性生成过程很少出现在ECMO中,但在相对长期(通常在几天或几周内)的ECMO治疗中会出现慢性凝血酶生成的情况。ECMO中许多因素可能促进TF的产生,如炎性反应和全身性感染都可能会触发TF从白细胞释放入血。 在ECMO过程中,凝血酶生成是需要抗凝的潜在原因,同时也是出血和血栓栓塞并发症的主要触发因素。 7.2.3 凝血酶生成后:纤维溶解系统激活 一旦凝血酶过量形成,就会进入血栓前状态。机体对这一状况的生理反应是纤溶系统的激活。通过来自内皮细胞的组织型纤溶酶原激活剂、来自体循环巨噬细胞或成纤维细胞的尿激酶或来自细菌的链激酶的释放,使纤溶酶原转化为纤溶酶。纤溶酶随即裂解纤维蛋白,释放纤维蛋白降解产物(FDP)。 ECMO中慢性凝血酶生成可能会激发纤溶亢进 [14] ,这可能是导致出血的因素之一。 7.3 ECMO的出血和血栓栓塞并发症 尽管在材料和技术上有所改进,出血和血栓栓塞并发症仍然是ECMO治疗的主要威胁 [15-16] ,也是最常见的致死原因 [17] 。除了脑卒中、肠系膜梗死和外周动脉血栓等主要血栓事件外,微小血栓形成被认为是ECMO患者缺血性器官功能障碍的主要原因 [18-19] 。 ECMO中有许多导致出血和血栓栓塞事件的风险因素,汇总列于表7.1。除以上因素外, ECMO 辅助模式的不同也会影响抗凝并发症。
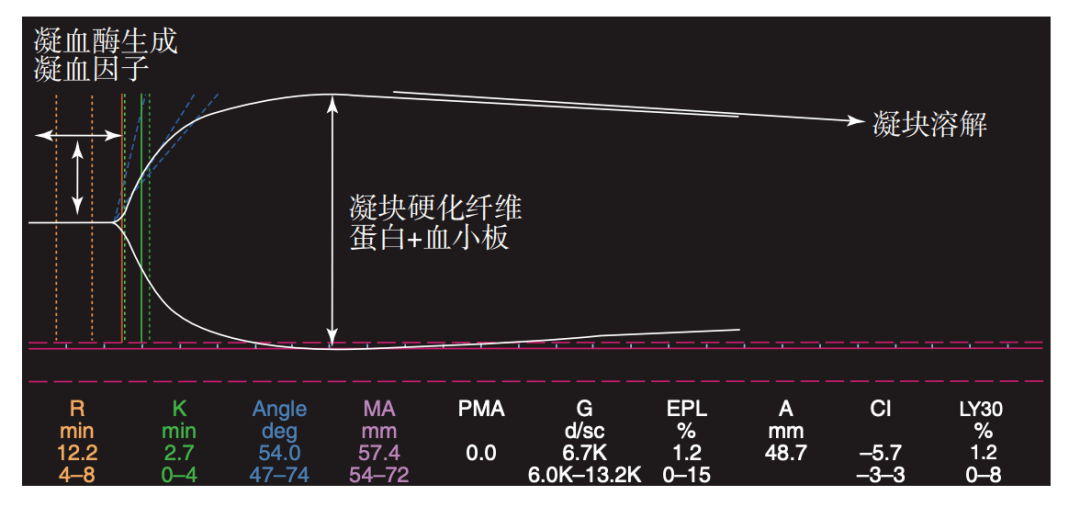
VV ECMO、外周VA ECMO和心脏手术后ECMO之间的差异很大。呼吸支持的VV ECMO一般通过外周股静脉插管或颈静脉+股静脉插管或双腔颈静脉插管;外周VA ECMO通常采用腹股沟血管插管;心脏手术后ECMO常应用于心脏手术后难以或无法脱离CPB的患者,在这一情况下,可以选择不同的插管策略。可选择外周动静脉ECMO,或右心房和升主动脉中央插管。这时可以选择特定的插管以闭合胸腔。 在开胸术后,即便封闭胸腔,心脏术后ECMO出现严重出血的风险也是非常大的。这是由于凝血系统已经被长时间CPB和术中产生的大量组织因子和凝血酶所抑制。其他因素如术后纤溶亢进、血小板减少、大剂量UFH、外科出血都会导致ECMO出血并发症。另一方面,术中抗凝血酶(AT)、组织因子途径抑制剂和蛋白C-S复合物等天然抗凝物质的消耗还可能导致栓塞风险。如7.4关于抗凝问题所述,至少在心脏术后头几个小时里,ECMO辅助需要一种不同的抗凝管理和UFH使用方案。 7.4 ECMO中的凝血管理 7.4.1 抗凝 ECMO中全身抗凝是为了控制凝血酶的生成并将血栓栓塞和出血并发症的风险降至最低。普通UFH是最常用的抗凝剂 [20] 。UFH通过与活化的X因子和凝血酶结合并使其失活而发挥作用。UFH并非凝血酶直接抑制剂,而是与抗凝血酶(AT)结合而起效。UFH可以使凝血酶—抗凝血酶结合的自然速率增加2 000~4 000倍。因此,UFH作为抗凝剂的作用依赖于AT的浓度。AT是一种“自杀性”物质,一旦与凝血酶和活化的X因子结合,只有通过肝脏才能进行解构。长期使用UFH将消耗内皮及血液循环中的AT。此外,UFH也会被血浆蛋白和内皮细胞表面结合而失活。UFH被血液循环中血小板释放的血小板因子4(PF4)清除是UFH清除最常见的原因。 鉴于如此复杂的情况, 在 ECMO期间准确抑制凝血酶生成所需UFH 的精确剂量并不确定,且常会变化。文献报道的传统剂量的范围是20~70 IU/(kg·h) [20] 。然而,UFH剂量个体间差异很大,即便同一患者, 不同状态剂量也有所不同。一般来说,长期UFH输注会导致AT消耗及随之而来的UFH耐药。一旦AT被纠正,所需UFH剂量则会减少。同时,在ECMO过程中血小板消耗是不可避免的,这会导致机体对UFH敏感性的增加;一旦补充外源性血小板使血小板计数恢复,UFH敏感性即会降低。因此,这些因素都要求不断调整UFH剂量。总体而言,ECMO辅助时间越长所需UFH剂量越大 [21] 。 尽管UFH有诸多缺点,也有报道无肝素、无抗凝剂基础上行ECMO的可行性,但UFH仍然在ECMO治疗中必不可少 [22-24] 。无抗凝剂的ECMO在诸如创伤等有严重出血风险的病例中可以考虑使用。 外周血管插管时,通常给予负荷剂量小剂量(50~100 IU/kg)UFH。而对于心脏术后ECMO,患者已经全量UFH化。插管和ECMO启动后,建议使用硫酸鱼精蛋白完全中和UFH。考虑体外循环及手术的残余效应,为避免术后大出血,第一个12~24 h可以不给UFH。一旦出血得到有效控制,UFH输注应从一个较低的剂量20 IU/(kg·h)开始,并逐渐调整至所需的水平。 7.4.2 UFH的替代品 理论上讲,直接凝血酶抑制剂可以作为UFH的替代品。在UFH诱导血小板减少症(HIT)病例中需要强制替换UFH。比伐卢定是一个具有约25 min较短半衰期的直接凝血酶抑制剂,部分(20%)经肾脏清除 [25-26] ,已有其在HIT 患者进行ECMO辅助期间成功应用的报道 [27-29] 。最近,一个大样本系列病例报道显示 [21] ,与常规UFH治疗相比,未患HIT患者在ECMO期间仅采用比伐卢定作为唯一抗凝药物,具有较低的出血风险和较少的外源性血制品需要。 比伐卢定的推荐剂量通常为0.03~0.2 mg/(kg·h),给 [27-29] 或不给 [21] 0.5 mg/kg的初始剂量均可接受。 在ECMO期间使用比伐卢定还有一些事项需要注意。首先,该药物经肾脏清除的特性对于肾功能不全的患者可能会导致药物蓄积;其次,比伐卢定抗凝需要血液循环且ECMO管道内不能有血液瘀滞。ECMO循环是封闭环路, 一般不会存在血液停滞的区域;同样在VV ECMO中血液循环内通常也没有瘀滞现象。相反,在心脏衰竭的VA ECMO中,部分患者左侧心腔会出现大面积血液瘀滞,这时瘀滞的血液表现的“烟雾效应”很容易在超声心动图中被检测到。这时心脏内血栓形成的风险很高,不应使用比伐卢定抗凝 [30] 。 对患HIT的患者进行ECMO辅助时,其他可用的直接凝血酶抑制剂还有阿加曲班0.1~0.4 mg/(kg·min) [31] ,以及过去曾使用但现已不用的达那肝素和重组水蛭素。 7.4.3 其他药物 有建议将抗血小板药物作为ECMO辅助时的附加剂,其旨在保护血小板功能并防止聚集,但还没有良好的证据支持。也有学者建议在无泵动静脉ECMO中使用阿司匹林1.5 mg/(kg·d) [32] 。曾经一度颇为流行的双嘧达莫 [33] 目前已鲜有报道。 当疑似纤溶亢进时(FDP和D-二聚体水平明显增加),可以使用合成抗纤溶药物应对 [34] 。 AT在UFH抗凝中对凝血酶的抑制作用已得到肯定,在ECMO期间会不可避免地被消耗。多数报道建议使用纯化的AT进行补充以维持其活性在正常值70%的水平 [35-36 ] 。但应注意,使用比伐卢定时,AT的消耗会大大减少 [21] 。 7.5 ECMO中对凝血系统的监测 7.5.1 激活全血凝固时间(ACT) ACT仍是目前ECMO辅助中UFH抗凝的标准监测指标。ACT可床旁检测, 并整体反映凝血过程中存内源性途径和共同通道。 在ECMO过程中,ACT通常保持在180~220 s [20] 。CPB过程中UFH浓度与ACT值的相关性较弱 [37-38] ,且直接检测UFH血药浓度也很难实现,所以ECMO中UFH的理想浓度并未确立。ECMO过程中UFH血药浓度与对应ACT 值的研究报告显示,当UFH浓度在0.1~0.4 IU/mL之间变化时对应的ACT值范围为110~220 s [ 39-41] 。 7.5.2 传统实验室检测 活化部分凝血活酶时间(APTT)揭示凝血的内源性途径和共同通道,是UFH抗凝治疗的经典监测指标 [20] 。APTT与ACT的相关性弱 [42] ,但它与UFH浓度的相关性在可接受范围内 [43] ,ECMO中对UFH抗凝的监测优于ACT。APTT 基线值的1.5倍(50~80 s)是ECMO治疗的目标范围,其相对应的UFH浓度为0.2~0.3 IU/mL [20] 。 凝血酶原时间(PT)是外源性凝血途径和共同途径的监测指标,可用于检测凝血因子水平,指导新鲜冰冻血浆(FFP)、凝血酶原复合物(PCC)或冷沉淀的使用。 ECMO辅助中应当每天进行血小板计数、纤维蛋白原水平和D-二聚体检测,以指导血小板、FFP、纤维蛋白原和抗纤溶药物的使用。 7.5.3 血栓弹力图和血栓弹力测定 血栓弹力图(TEG)和血栓弹力测定(TEM)是基于血液在凝固过程中黏性弹力性能改变而进行的动态测试。这两项测试中,血液的物理性质从液态转变为凝胶(凝胶点)的时间以直线表示,分别定义为r时间(r time)(TEG)和凝血时间(coagulation time)(TEM)。一旦达到凝胶点,即由其他参数来描述血栓形成的动态过程(α角)和凝块收缩力(TEG为最大幅度, TEM为最大凝块硬度)。最后,随着时间的推移,以纤维蛋白溶解指数表示凝块强度的下降(TEG为凝块溶解指数,TEM为最大溶解量)(图7.1)。
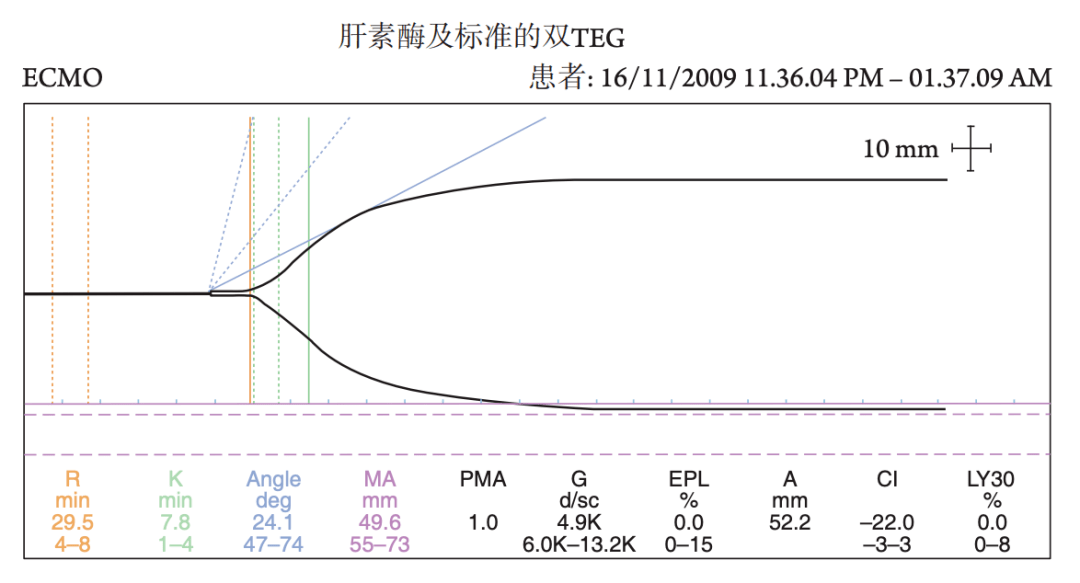
图7.1 血栓弹力图分析 TEG和TEM相比常规凝血监测有很多优势。他们能提供凝血动力学的综合动态分析,可以进行床旁检测并在30 min左右得到数据,还可用于检测纤溶亢进。因此,近几年被广泛应用于凝血和抗凝的监测。 TEG和TEM可作为监测凝血酶生成的替代指标,在ECMO中指导UFH的输注速度。目前还没有一个普遍接受的TEG值指导最佳UFH剂量,但大部分作者报道认为最佳窗口值为正常值上限的2~3倍之间(16~25 min) [20-21] (图7.2)。
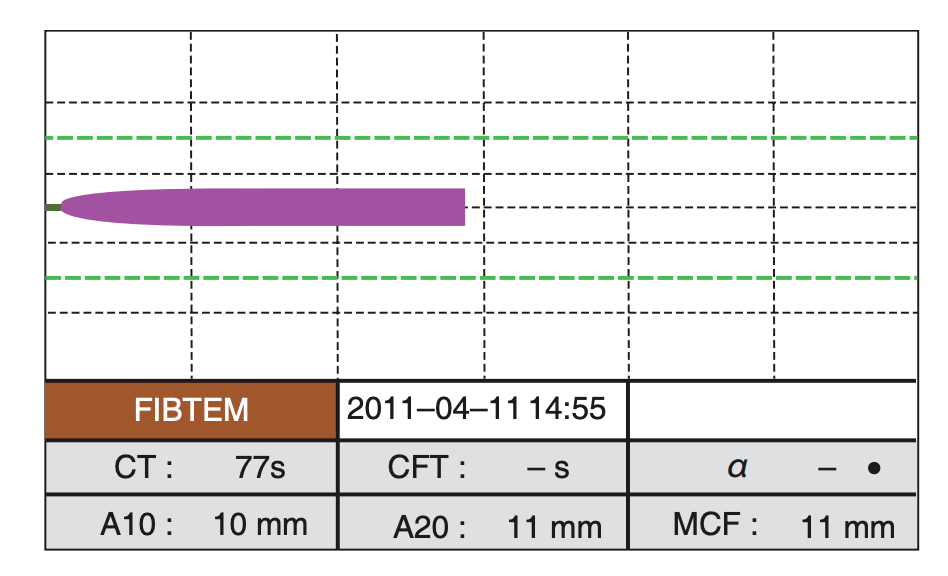
图7.2 ECMO过程中的TEG检测 TEG和TEM还可提供更加丰富的检测项目。例如在检测样本中添加UFH 酶,可以检测血凝块形成的“自然”过程。特别是当TEG过度延长时,它能将UFH过量与凝血因子缺乏进行鉴别并指导PCC、FFP或冷沉淀的使用。其他的特殊检测(TEG中的functional fibrinogen和TEM中的fibtem)可进行纤维蛋白原浓度的测定(图7.3),指导FFP和纤维蛋白原的使用。
图7.3 纤维蛋白原浓度的ROTEM分析(FIBTEM) 7.5.4 其他出凝血检测 由于ACT的局限性及APTT数值随检测方法不同的变异,部分学者 [44] 建议使用更加特异性的方法来指导UFH剂量。UFH anti-Xa测定是对血浆中UFH anti- Xa的活性进行检测,对应APTT基线1.5~2倍的anti-Xa活性为0.3~0.7 IU/mL。 7.6 凝血状态的调整 通过以上分析,可以得到ECMO过程中“最佳”凝血监测方法。这些监测项目如表7.2所示。
最佳的凝血监测是ECMO中的关键步骤。UFH或比伐卢定剂量应根据ACT、APTT和TEG/TEM数据进行调整。其他指标则可通过同种异体血制品或替代品调整。 纯化的AT可用于AT消耗的补充。也可以使用FFP对AT进行补充,但所需用量非常大。 血浆凝血因子严重缺乏(INR-3)时可用PCC或冷沉淀纠正,而轻微缺乏(INR2~3)则可以用FFP补充。在凝血因子缺乏所致危及生命的出血情况下,可以考虑使用重组活化Ⅶ因子(rFⅦa)。但需要注意:要达到疗效,必须有足够的血小板和纤维蛋白原支持。rFⅦa会增加血栓栓塞事件的风险 [45] 。 纤维蛋白原,作为一个活动相蛋白通常在ECMO过程中逐步增加 [21] 。但是在心脏术后ECMO中,ECMO辅助最初1 h内,纤维蛋白原水平会很低。建议纤维蛋白原水平至少在100 mg/dL以上 [20] ,在TEM中对应的最大血凝块硬度>10 mm [46] 。纤维蛋白原可以用冷沉淀或FFP补充,但FFP的补充量需要很大。 使用6-氨基己酸、氨甲环酸进行抗纤溶治疗应该在TEG/TEM或常规凝血检测提示持续存在纤溶亢进表现时便开始。在ECMO过程中总是会存在一定程度的纤维溶解,D-二聚体在300 μg/L左右是可以接受的,但一旦出现持续升高迹象即应该及时干预。 对于有活动性出血或高危出血风险的患者,应输注浓缩血小板使其维持在80 000/mmc以上。相反,对于非出血或低出血风险患者,较低的血小板计数(>45 000/mmc)是可以接受的 [20] 。 上述所有数据都应基于患者的实际情况决定:出血患者应进行及时、积极的处理,通过全套凝血检测指标指导同种异体血制品或替代物治疗。与此相反,非出血患者则应侧重保守治疗,更关注患者的实际情况而非监测数据。 最后,应通过输注浓缩红细胞维持血红蛋白在8 g/dL以上,根据患者实际临床状况的不同,最低血红蛋白水平还可更高。 7.7 ECMO中的一些特别情况 7.7.1 UFH诱导血小板减少症 相比其他患者人群,接受ECMO和心室辅助装置的患者更易出现HIT,据报道发生率在15%左右 [47-48] 。有其他原因导致血小板计数过低时,HIT可能较难诊断。疑似HIT时,应该通过抗血小板4因子–UFH复合物(anti-PF4-heparin complex)抗体检测加以证实。确诊HIT后应停用UFH,用直接凝血酶抑制剂(比伐卢定或阿加曲班)取而代之。 7.7.2 获得性血管性血友病 获得性血管性血友病的特点是血管性血友病因子的大量缺失以及之后的血小板无法黏附在受损的内皮细胞上。这一状况在ECMO患者中很常见,可能源于离心泵所产生的高剪切力。然而,目前还不清楚这种情况是否与临床出血有关,是否需要治疗(因子置换或去氨加压素) [49] 。 7.8 全身炎症反应与ECMO ECMO可诱导多种炎症通路的激活。有些通过与异物表面的接触直接激活,另外一些则通过组织因子的释放和凝血酶生成而激活。从这一点来看,ECMO是一个理解炎症和凝血之间复杂相互关系的完美模型 [50] 。 异表面接触通过替代途径激活补体系统,生成C3a(替代途径)和C5a(经典途径) [51] 。激活的补体进一步诱导细胞因子的合成,产生促炎细胞因子(IL-6、IL-8、TNF-α)和抗炎细胞因子(IL-10) [52-54] 。促炎细胞因子参与血管通透性增加与内皮细胞功能障碍。另一个炎症机制涉及内毒素的释放。革兰氏阴性菌释放的细菌黏多糖诱导巨噬细胞释放TNF-α [55] 和内皮细胞释放IL-6 [56] 。在ECMO或CPB过程中,内毒素可能主要由低灌注肠黏膜迁移的细菌释放 [57-58] 。 内毒素激活血液循环中的单核细胞,从而使后者释放细胞因子和血源性组织因子,随后激活凝血级联反应。凝血酶形成过程的激活进一步促进炎症反应,形成恶性循环。凝血激活的抑制在很大程度上与生物相容性表面抑制补体和中性粒细胞激活以及细胞因子释放有关 [2-6] 。 声明 本文作者宣称无任何利益冲突。 译者:赵爽,天津市第四中心医院检验科 审校:郭震,上海交通大学附属胸科医院体外循环与生命辅助亚专科 点 评 血栓与出血是ECMO辅助中最常见的并发症,也是导致ECMO失败的主要原因。这主要源于ECMO辅助中机体凝血、抗凝、纤溶、补体和炎性反应的激活以及它们之间错综复杂的相互关系。这种病理生理的复杂变化给精确控制抗凝和凝血之间的平衡带来巨大的困难。充分理解和认识它们之间的关系以及选择最佳的抗凝方法和抗凝监测手段是避免此类并发症的基础。本章即从这方面阐述了ECMO辅助中有关抗凝和监测的基本问题,希望对读者临床工作提供一些参考。 ——郭震 纸质书购买链接 点击查看电子版 ECMO——成人的体外生命支持资讯 b.03.20 21.01.27.01 点击 查看本书更多内容返回搜狐,查看更多 |
【本文地址】