| 质量源于设计(QbD)在药物分析方法开发中的应用研究进展 | 您所在的位置:网站首页 › drylab软件下载 › 质量源于设计(QbD)在药物分析方法开发中的应用研究进展 |
质量源于设计(QbD)在药物分析方法开发中的应用研究进展
|
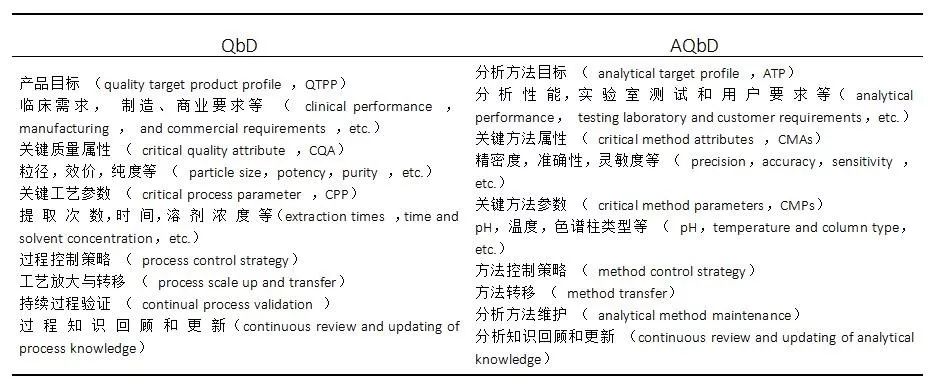
01 QbD与AQbD的比较 QbD 在分析方法开发中的应用与在制药过程中的应用相似。制药过程是生产出满足临床治病要求的药品,分析过程则是产出能用以评价药品质量的分析结果。因此, 制药过程 QbD 中的关键要素均可以映射至分析方法开发过程 (见表 1)。表 1从过程目标、关键属性、关键参数、控制策略等方面对 QbD 和 AQbD 进行了比较。 表 1 QbD 和 AQbD 相关术语的比较
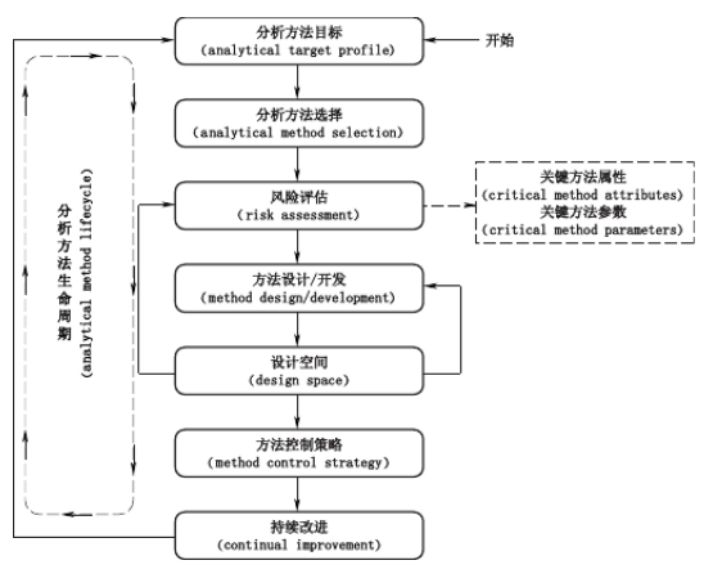
02 AQbD实施步骤 AQbD方法学由若干关键元素组成, 即分析方法目标、风险评估(risk evaluation )、关键方法属性、关键方法参数、设计空间和控制策略(control strategy),这些元素的有机组合构成了AQbD理念指导下的分析方法开发步骤和策略。
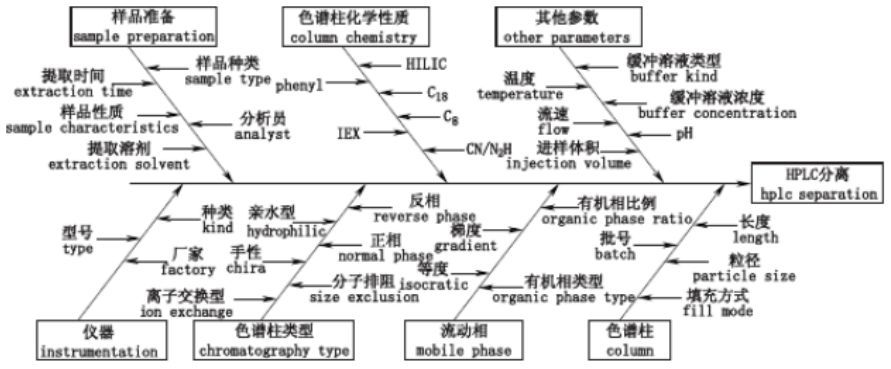
图 1 基于 AQbD 的药物分析方法开发示意图 图 1 展示了基于AQbD理念的分析方法开发流程, 即分析方法生命周期(analytical method lifecycle ,AML)。AML 开始于分析方法目标,在确定目标的基础上选择合适的分析分离技术进行方法开发, 将分析方法目标转换为可量化评价的关键方法属性, 通过风险评估辨识关键方法参数,通过实验设计获取数据, 建立反映关键方法参数和关键方法属性之间多维相互作用关系的多变量数学模型,基于分析过程数学模型确定方法操作区域即设计空间,最后建立分析方法控制策略并开展方法性能持续改进。若无法建立设计空间或者所建设计空间不稳定,可再次考虑方法设计和风险评估的合理性,并开发满足分析方法目标要求的设计空间, 而不必等到方法完全建立后发现不合适而重新开发, 因而可以节约成本和时间。在方法应用过程中, 发现所建方法不再满足分析方法目标时,可进行方法再开发或重新考虑分析方法目标的设置。分析方法开发的每一步都要基于科学和风险的原则选择合理的工具,而不能为建立分析方法而将AQbD 要素进行简单的堆砌。在实际应用中, AML是一个螺旋递进的过程,可以根据需要对分析方法的性能进行不断改进。 2.1 分析方法目标定义 QbD 是以预定义目标开始的强调对产品和过程理解以及控制的指导药品开发的系统方法。对于AQbD,首先需要明确分析方法目标, 即分析方法需要测量的对象及其要求的水平, 分析方法目标决定了分析方法开发的质量和效果, 并贯穿于分析方法开发的各个环节和整个生命周期。分析方法目标在分析方法和产品质量或者制剂工艺之间提供了一种关联,分析方法目标设置的合理性在一定程度上决定了产品或制剂过程质量控制的有效性, 不同的分析方法在其生命周期的不同阶段需要满足不同的分析方法目标。在日常应用中,分析方法目标也可作为对分析方法进行管理和评价的依据。常规分析方法性能评价指标,如准确度、精密度、线性范围、检测限、灵敏度等,均可纳入分析方法目标范畴。在具体方法开发时,需结合应用环境, 参照相关法规和指南的要求, 如ICH Q2A 等,为各性能指标设定合理的目标限度。如开发中药复杂体系 HPLC 分析方法时, 可以从多个方面来考虑分析方法目标设置:一是从色谱分离角度,希望尽可能将中药中的指标成分进行分离, 可选用分离度来作为分析方法目标;由于中药成分的复杂性,除指标成分外,还可设计中药色谱指纹图谱或特征图谱进行整体评价;另外也可以从分离效率角度考虑,选择缩短分析时间及减少有机溶剂用量等分析方法目标。 2.2 分析方法选择 在确定分析方法目标后, 可以根据流程图或者决策树[24-25 ]来辅助选择合适的分析方法。分析方法开发人员需了解可用分析技术的使用范围与使用特点,如 HPLC、MS等。使用流程图和决策树的目的是将分析学科里的传统知识和最新分析技术结合共同用于方法开发。 在确定分析方法后, 则可根据分析方法目标定义关键方法属性。ICH Q8 对药品关键质量属性的定义为“一种物理的、 化学的、生物的或者微生物的性质或特征,其应当具有合适的限度、 范围或分布, 以确保获得预期的产品质量” 。而在分析方法中, 关键方法属性是评价方法优劣的指标, 决定分析方法用以评价药品质量与安全的有效性。例如, 在药品杂质含量的 HPLC 分析法中, API 与杂质是否基线分离将影响对杂质的判定, 进而影响药品的安全性。对于一般的HPLC 分析,关键方法属性可以从 2 个方面来考虑,一是从色谱分离情况来评价, 如分析时间、 分离度、两相邻峰之间的距离、 塔板数、拖尾因子等, 二是从方法的性能来评价, 如准确度、精密度、线性、范围、耐用性等。一般而言,分析方法目标是宽泛的, 而关键方法属性是具体的、 可量化的。不同分析方法的开发, 其关键方法属性是不同的。 2.3 风险评估 在 AQbD 方法体系中, 风险评估主要应用于关键方法参数的辨识。ICH Q8 对药品关键工艺参数(critical process parameters,CPPs)的定义为 “在药品生产过程中必须被严格的监测和控制的对关键质量属性有显著影响的过程参数” 。而在分析方法中, 关键方法参数则是对分析过程和分析性能具有显著影响的参数。以 HPLC 方法开发为例, 关键方法参数可以从样品处理、 仪器、试剂、色谱柱、流动相等方面来考虑,如图 2 所示。不同的分析对象和分析方法, 筛选出的关键方法参数不同。对于风险高的因素要严格进行控制, 甚至改变分析方法。
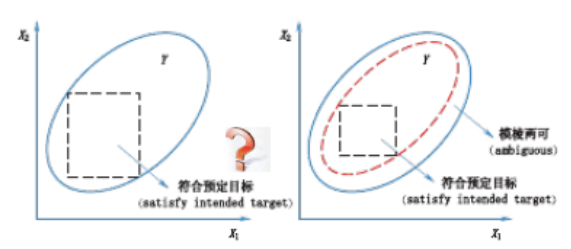
图 2 HPLC 分析方法开发的参数风险评估石川图 根据 ICH Q9“质量风险管理”的要求,风险管理应贯穿于药品开发和使用的整个生命周期。而在分析方法开发过程中,风险评估应贯穿于分析方法开发、验证和应用的全过程,在分析方法的整个生命周期内,都要确认高风险因素的风险性是否可被降低或处于受控状态。ICH Q9 给出风险评估的一般步骤包括风险辨识、风险分析和风险评价。风险辨识是系统的运用历史数据、 理论分析和经验分析来辨识危险因素,主要关注 “什么可能出错” 的问题。风险分析则是在风险辨识的基础上对已经辨识的因素进行估计。风险评价是将已辨识和分析的风险与风险标准进行比较。风险评估可借助风险管理工具,如鱼骨图、失败模式和效应分析 ( failure mode and effects analysis ,FMEA)等[26]。风险评估的结果是对风险的定量或定性描述。如采用 “高”、“中”、“低”等对风险进行定性分档。也可以借助FMEA 中的风险优先指数 ( riskpriority number ,RPN)[27]进行对风险进行定量描述。RPN 计算中主要包括 3 个参数,分别是严重性(S)、发生率 (O)和难测度 ( D),三者均可以分档打分;RPN 计算公式为 RPN=S× O×D,分数越高代表风险越大。 2.4 方法设计与开发 在明确关键方法参数和关键方法属性后, 需要采用实验的方法确定两者之间的关联关系。常规的方法开发是采用 “试错法 (trial and error )”,但需要方法开发者具备丰富的经验。也可采用单因素考察法(one factor at time ,OFAT),即每次变化 1 个实验参数,该方法简单易操作,但无法考察因素之间的交互作用。AQbD 鼓励采用实验设计的方法。通过实验设计,可以显著降低实验次数, 提高实验效率, 并且可以对关键方法参数和关键方法属性之间的关系进行量化研究。目前, AQbD 中常用的实验设计方法包括筛选型实验设计和优化型实验设计。在进行方法开发时,可有选择地进行筛选实验设计或者优化实验设计中的 1 种,也可以将两者结合进行。 2.4.1 筛选实验设计 筛选实验设计的目的是通过形式简单但精确度较低的经验模型, 从众多的因素中筛选出少数对响应变量有显著影响的因素, 如部分析因设计、 Plackett-Burman 设计等 [28]。在实际操作中,可采用风险评估的方法预先选出一些高风险的因素,作为潜在关键方法参数 (potential critical methodparameters,pCMPs),进一步可采用筛选实验设计对潜在关键方法参数的关键性进行确认。潜在关键方法参数可以是连续型变量也可以是离散型变量, 例如在色谱方法开发中常见的离散型变量为色谱柱和流动相种类等, 而连续型变量为柱温、 pH、有机相浓度等。在筛选型实验中,待筛选参数一般多于 3 个,每个参数设置高低 2 个水平。需要注意的是, 基于筛选实验设计所得的数据分析模型 (如多元线性回归模型、方差分析模型等) 中仅包括低阶的交互作用。 2.4.2 优化实验设计 优化实验设计一般是在筛选实验的基础上序贯进行, 从筛选实验中得到的对响应变量有显著影响的参数(即关键方法参数) ,对这些参数进行进一步考察,以便更加细致地考察关键方法参数与关键方法属性之间的关系。参与优化实验设计的参数一般为 2 至 3 个,参数水平一般大于2水平,所需的实验次数一般较多。常用的优化实验设计方法有中心点复合设计(即星点设计) 、Box-Behnken设计 [29]、Doehlert 设计[30]和 D- 优化设计[31]等。建立在优化实验数据基础上的数学模型, 如二次多项式回归模型、偏最小二乘回归 (PLSR)模型等,不仅包括简单的交互作用, 还包括复杂的交互作用。在经过模型评价且模型校正和预测误差在可接受范围内时,可将模型用于预测指定关键方法参数组合条件下的响应变量值, 但不宜将模型外推至实验参数范围之外。 2.5 设计空间构建 设计空间是 AQbD 的核心部分, 体现了关键方法参数与关键方法属性之间的多维组合与交互作用。设计空间与分析方法目标直接相关, 分析方法目标决定了设计空间的大小和范围。有学者将分析方法设计空间定义为 “可操作的方法设计区域 (methodoperable design region,MODR)”[ 5,32-34],并以此将其与制药工艺设计空间进行区分。建立分析方法设计空间的主要目的是增加对整个分析程序的理解 [ 35],并在日常实验时能够灵活使用分析方法, 避免批准后变更方法所带来的问题。 设计空间是基于分析过程数学模型开发的, 而模型存在预测误差, 故设计空间也存在不确定性, 因此设计空间的可靠性直接影响分析方法的准确性和可靠性。目前, 设计空间可靠性还没有公认的定义,也没有任何监管文件对分析方法设计空间的可靠性做出要求。文献报道中通常将设计空间可靠性可转化为由于建模误差导致的设计空间边界的不确定性问题的求解, 其中最具代表性的是 Little 等[36]提出的失败边界 (edge of failure )概念。如图 3 所示[37],Y 代表响应值, X1 和 X2 为 2 个关键方法参数, 实线椭圆形代表关键方法属性 Y 的响应面;Y 值代表的是预测平均值,而不是由 X1 和 X2 变化引起的真正的 Y 的结果,因此位于椭圆形边缘上的点只有约 50% 的可能来满足方法目标要求, 因此若在实线椭圆中黑色方框所代表的控制空间内改变关键方法参数不一定都符合预定目标;红色虚线椭圆则考虑了这一点, 虚线椭圆中虚线方框所代表的控制空间内的参数组合是以较高概率满足预定目标的;2 个椭圆形之间则是模棱两可的条件即失败边界, 当分析条件位于这部分区域,那么分析方法就存在一定的风险, 因而设计空间的可靠性主要也是体现在设计空间的边界上。已报道的用于设计空间可靠性的评价的方法包括区间估计法[38]、贝叶斯方法 [ 39-41]、Bootstrap 抽样法[ 42]和蒙特卡罗仿真法等[ 43-46 ]。
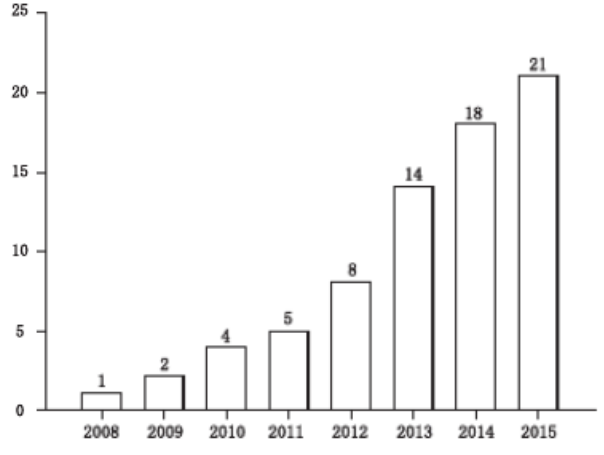
图 3 设计空间的可靠性示意图 2.6 控制策略 根据 ICH Q8 指南,控制策略是指一套源于对当前产品和工艺过程的理解, 确保过程性能和产品质量的有计划的控制。在分析方法开发中, 控制策略能确保方法在日常使用中按照分析方法目标的要求进行。控制策略的制订可从多个方面进行考虑, 如样品、流动相系统、仪器系统、关键方法属性等。另外, 支撑产品质量标准的分析方法在开发时是在有限分析系统上完成的,其推广使用须考察分析方法对不同硬件系统的适用能力。 在制定控制策略时, 需结合进一步的风险评估结果。如果风险评估结果表明, 在设计空间内变更关键方法参数, 均可满足分析方法目标要求, 且分析方法失败风险较低, 则可建立基于设计空间的控制策略。若在进行方法开发时, 各个步骤都没有问题, 但仍无法满足分析方法目标,则可根据经验适当增加一些额外的条件来制定控制策略。如 Zhou 等[47]研究了卡尔费歇尔滴定 ( Karl Fischer titration ,KFT)中的 7个方法参数,发现由实验设计中确定的参数范围远大于它们在常规使用中的范围,这时就需要将窄的方法参数范围纳入控制策略,而不能单纯依赖实验设计分析的结果。 2.7 方法验证 对于任何一个新建立的方法在进行应用之前都需要进行方法学验证, 各国药典和各类指南文件, 如ICHQ2( R1)等[48],均有对分析方法验证作出了具体说明,并要求针对不同的验证项目, 如精密度、 准确性、线性、范围等,分别进行考察, 判断其是否在规定的范围内。如 Schmidt 等[49]在建立一种抗组胺制剂中依巴斯汀 (ebastine)的 UHPLC 分析方法时,分别验证了方法的专属性、准确性、中间精密度、 重复性、定量限、检测限和线性。Furlanetto 等[ 50]在建立一种抗抑郁制剂中阿米替林 (amitriptyline )的胶束电动毛细管色谱分析方法时, 验证了方法选择性、 系统重复性、定量限、检测限、线性、范围、准确度、精密度和中间精密度。Mark 等[51]建议采用 QbD 理念进行方法验证,即分析方法验证源于设计 (method validationby design,MVbD)。也有研究者选择采用 Feinberg[52]提出的准确性轮廓 (accuracy profile ,AP)方法进行分析方法验证。准确性轮廓是评估分析方法是否有效的决策工具, 整合了几乎所有常用的验证指标, 如准确性、 真实性、精密度、定量限、风险性、线性和范围等。其核心是在合理的验证实验设计和结果统计分析的基础上, 综合分析方法的系统误差和偶然误差,基于β- 期望容许区间 (β-expectation toleranceinterval)[53]或 β- 容度容许区间 (β-content toleranceinterval)[54]对分析方法在不同条件 (如浓度水平) 下的准确度进行估计, 并给以直观的图示, 全面评价方法的准确性和可靠性。如 Rafamantanana等[55]采用AQbD 理念建立阿朴啡 (aporphine)生物碱的分析方法,采用了准确性轮廓方法进行方法验证。 03 AQbD的应用 在 Web of Knowledge上,以 QbD和 analytical method为关键词进行检索发现, 从2008 年至今,AQbD 理念在分析方法开发中的应用研究论文共 73 篇,呈逐年上升趋势 (图 4)。
图 4 2008-2015 应用 AQbD 的文章( 2008 年至 2015) 3.1 基于AQbD的分析方法开发 目前,AQbD 在 HPLC 分析方法开发中应用广泛,如 Backer 等[56]采用 HPLC-DAD 建立了印度大麻中大麻素类成分的定性定量方法;Gavin 等[57]采用 ion-pairing HPLC 建立了盐酸阿托西汀的定量方法;Rafamantanana等[55]采用 HPLC-UV 建立了防己中生物碱类成分的测定方法;马丹丹 [58]将 QbD 引入拉唑类药物 HPLC 分析方法的建立;沈熊[59]等应用QbD优化大鼠血浆中大黄蒽醌类成分的高效液相色谱 - 荧光检测(HPLC-FLD )分析法。 近年来,AQbD逐步扩展应用于超高效液相色谱法(ultra-performance liquid chromatography ,UPLC)[49,60-67]、毛细管电泳法(capillary electrophoresis,CE)[50,68-71]、酶联免疫法(enzyme linked immunosorbent assay,ELISA)[72]、N- 聚丙烯酰胺凝胶电泳(native polyacrylamidegel electrophoresis,N-PAGE )[73]、在线质谱直接分析法(direct analysis in real time massspectrometry,DARTMS )[74]、超临 界流体色谱法(supercritical fluid chromatography ,SFC)[75]、卡尔 费歇尔滴定法(Karl Fischer titration ,KFT)[47,76] 、在线近红外(on-line near infrared,NIR)光谱分析法[77-78],以及一些分析联用技术,如 UPLC-MS[79]、LC-MS/MS[80-82]和GC-MS/MS[83]等分析方法,表明AQbD 理念应用的深度和广度都在不断增加,对其认识和理解也不断在加深。 3.2 辅助 AQbD 实施的统计软件 AQbD 方法实施过程中,涉及多种实验设计方法的选择和大量的统计建模分析工作,可借助不同的计算机软件完成。常见软件包括JMP[57,73,75,84-90]、Fusion[15,60,66,91-94]、Drylab[14,16,18,49,61,64 ,95-99 ]、Design-Expert[62,65,68,72,80,100-105]、MODDE [50,67,69-71,80]和ChromSword[20]等,也可以通过自编程序完成[8,46, 63,79,82-83,106-110]。Drylab和ChromSword是能够进行快速、系统地实施HPLC方法开发的专家系统,可广泛用于各类样品的HPLC分析方法开发;Drylab 软件仅依靠 2 次预实验便可以得到有关色谱分离的大量信息,可以迅速获得对方法关键方法参数与关键方法属性关系的理解,并指导分析方法的深度开发。如 Monks等[18]将Drylab软件植入UHPLC控制系统,把Drylab软件中所需的实验条件输入到控制系统中,由UHPLC自动完成相关实验,再将结果自动传输到 Drylab 软件中,完成数据的采集和统计建模,并建立了某滴眼剂的色谱分析方法设计空间。ChromSword软件则是主要采用四面体优化法,在充分了解样品结构与色谱柱填料和流动相pH、离子强度、洗脱能力、梯度等因素之后,才能获得数据分析结果,该软件比Drylab 软件需要进行的实验次数多一些。如Musters等[20]使用 ChromSword软件完成了某新药的UHPLC分析方法开发。JMP、Fusion、Design-Expert 、MODDE 和 Fusion软件则可提供不同类型的实验设计方法,可以根据需要进行灵活选用。 上述软件在不同程度上对AQbD的应用起到辅助作用,使得AQbD在使用时更加方便和快速。但需要注意的是有意义且可靠的实验结论取决于实验设计者对于分析实验目的和开发过程的理解和控制, 如对方法开发中具体问题的认识和判断、关键方法属性的选取、关键方法参数及其水平的设置、风险管理工具的使用、模型的评价标准和优化验证等,而不能完全依赖软件。 04 总结与展望 从制药QbD的正式提出到现如今10多年的发展历程里,QbD相关概念和方法体系在制药行业实践中不断发展和完善,有效促进了药品整体质量水平的提高。AQbD作为QbD理念在药物分析领域的延伸,提高了分析方法开发的效率,充分保证了分析结果的准确性和可靠性,为保障药品的安全有效和稳定可控奠定了坚实基础。目前, AQbD 的应用对象以化学药品为主,在生物制品和中药分析中应用较少。另外,AQbD 方法学体系中尚有很多方面需要继续探讨,例如复杂体系分析方法目标和关键方法属性的确定、设计空间的可靠性评价方法和评价标准、设计空间的转移方法和持续改进等。希望 AQbD 理念在分析方法开发中的成功应用可以使复杂的药物分析过程变得更加简单、透明和易于操作, 使分析结果更加准确可信。 参考文献:略 【来源:药物分析杂志】
免责声明: 本文信息部分内容来自网络文章,不保证所有信息、文本、图形、链接及其他项目的绝对准确性和完整性,故仅供访问者参照使用。如您(单位或个人)认为本文某部分内容有侵权嫌疑,敬请立即通知我们,我们将在第一时间予以更正或删除。以上声明之解释权归本公众号所有。法律上有相关解释的,以中国法律之解释为基准。如有争议限在我方所在地司法部门解决。谢谢。返回搜狐,查看更多 |
【本文地址】