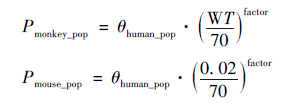| 新药人体首次剂量设计的技术考虑 | 您所在的位置:网站首页 › cl怎么换算ml › 新药人体首次剂量设计的技术考虑 |
新药人体首次剂量设计的技术考虑
|
在过去的几十年里,已经开发了许多经验性和生理学的定量估算人体首次 MRSD方法,每种方法都有其优缺点。TGN1412 FIH 研究事件发生之后,加强了对生物制品FIH 研究中 MRSD估算方法的关注。强调新型生物制品FIH 研究中 MRSD选择应考虑多个因素,例如不同的终点、种属间缩放和安全系数[5 -6] 。文献中使用PK⁃PD 建模的FIH 研究设计实例有限,造成对 MABEL 的解释和PK⁃PD 原理在 MABEL剂量估算中的应用缺乏清晰的认识。本文旨在梳理FIH 研究中 MRSD估算的规则,并举例介绍常用的FIH 剂量估算方法,对各种方法的适用性和优缺点进行讨论,为新药研发和评价人员提供一份实用的参考。 1 NOAEL缩放估算成年健康志愿者人体首次剂量 计划进行人体首次研究时,多数药物只有有限的非临床动物试验数据。根据动物数据推算人体预测值是合理确定人体首次研究剂量的关键。许多生理学过程和器官大小(θ)遵循幂律[7] :
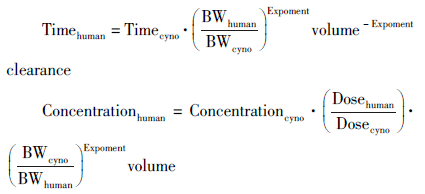
2005 年7 月,美国FDA 发布的“成年健康志愿者首次临床试验最大安全起始剂量估算”指南中,其HED 的计算即基于幂律的异速缩放,推导得出推算公式如下[1] : 通常,人体等效剂量计算中以mg·m-2 标准化的b 值为0.67。带入公式(2)即得 。FDA 指南中,按照各试验动物和人体的标准体重给出了常用动物的剂量转换因子[1] 。 指南建议 MRSD的选择过程如下:① 确定每种试验动物的 NOAEL。② 使用适当的缩放因子将 NOAEL转换为HED。③ 使用安全因子,由HED 计算确定人体 MRSD。对于多数全身给药的药物,应采用体表面积校正后的剂量计算HED。一般认为HED 最低的种属为最敏感种属,但当临床前毒性数据表明某一种属更适合评估人体风险时,则后续计算应使用该种属的HED,不论其是否为最敏感种属。这种情况多见于对人体靶蛋白具有高度选择性结合,而在毒性试验常用种属中的反应性有限的生物制品。最适合种属的HED 除以安全系数得到 MRSD,安全系数一般至少为10,并根据药物性质、药理活性种属差异和非临床试验结果的不确定性等因素调整安全系数值。 指南中种属间换算因子既适用于小分子也适用于生物制品。对于小分子化学实体,基于 NOAEL的保守方法具有良好的安全记录,简单实用。然而,该方法可能忽略了对药理活性剂量的考虑,2006年,针对T 淋巴细胞的单克隆抗体TGN1412 的FIH临床试验中,6 名健康志愿者产生多器官衰竭[8] ,虽然其选择 MRSD(0. 1 mg·kg -1)时,在食蟹猴NOA⁃EL 缩放的HED(16 mg·kg -1)中使用了非常保守的安全系数160。 内容由凡默谷小编查阅文献选取,排版与编辑为原创。如转载,请尊重劳动成果,注明来源于凡默谷公众号。 2 最大耐受剂量( maximal tolerable dose, MTD)缩放用于抗肿瘤药物人体首次剂量估算 由于抗肿瘤药物适应证人群的特殊性,可接受更高的潜在毒性/ 不良反应风险;人体首次临床试验通常在癌症患者中进行,从伦理学方面考虑应确保受试者治疗获益。因此通常基于非临床的MTD 或者最高非严重毒性剂量(highest non-servicely toxicdose, HNSTD)估算人体首次剂量。Freireich[9] 和chein 等[10] 研究表明,对于抗肿瘤药物,如果剂量标准化为相同给药方案,并以mg·m-2表示,啮齿类10% 致死剂量和非啮齿类MTD 与人MTD 之间具有良好相关性。大量研究表明,b =0. 75 最适合MTD 的种属间缩放。药动学协调组织(The International Pharmacokinetics Group)建议在致癌性研究中种属间外推采用W0.75 ,等效剂量计算公式为: 提示,不同的生理学及其相关参数均符合幂律,但缩放指数可能不同。 小分子抗癌药物起始剂量确定的传统模式是啮齿类动物10% 严重毒性剂量(servicely toxic dose, STD10)的1/10(≤10% STD10)[11] 。如果非啮齿类是最合适动物[12] ,初始剂量为不产生死亡、危及生命或不可逆毒性的 HNSTD的1/6。Hansen 等[13] 对 23 种(其中21 种为单抗)生物制品进行回顾性分析,评估在晚期癌症FIH 试验中使用1/6 的 HNSTD作为起始剂量的安全性。结果显示,1/6 HNSTD(以mg·m-2 异速缩放) 均没有超过Ⅱ 期推荐剂量(RP2D),可以作为生物制品的安全起始剂量。 3 MABEL 法人体首次剂量估算举例介绍 鉴于TGN1412 的悲剧事件,EMA 于2007 年发布了“确定和减轻研究型新药人体首次临床试验风险的策略”,引入了 MABEL法。 MABEL是指与任何生物效应相关的最低剂量,无论是毒性作用还是预期的药理作用[14] 。 MABEL 法中人体有效剂量预测包括下述步骤:① 定义有效性/ 无毒性终点指标,并在有效性/ 毒性模型中建立暴露量⁃反应关系。② 采用简化异速缩放或种属不变时间法( 如果预计为非线性PK,TMDD 建模) 由动物实验数据预测人体PK 概况。③ 将PK/ PD 有效性模型与人体PK 预测值整合估算人体有效剂量。 3. 1 动物实验PK 参数的异速缩放 从临床前动物实验数据预测人体PK/ PD 参数是 MABEL法估算FIH 起始剂量的重要步骤。人们普遍认为,由于控制其生物分布和消除的种属机制相对保守,肽类和蛋白类药物较小分子药物更可能表现出异速PK 关系[15 -17] 。为了便于对PKPD 模型的理解,以单抗为例说明生物制剂的体内过程。通常单克隆抗体全身给药后在循环中表现为双相PK 特征,即一个相对较快的分布阶段及随后较慢的消除阶段;由于分子较大和极性,单抗局限性分布在血液系统和组织间隙,分布容积低(3 ~ 8 L)、FcRn 介导的再循环导致半衰期长(人体中约为11 ~30 d),体内主要清除途径: ① 与FcRn 受体结合的非特异性细胞內吞及与肝脏和网状内皮系统中表达FcγR 受体的细胞结合介导的溶酶体内吞和降解(非特异性清除)。 ② 靶标介导(抗原抗体结合)的内化酶解(特异性清除)。 ③ 其他机制如抗药抗体(anti-drug antibody, ADA)介导的清除(通过FcγR 介导的内吞作用)。低剂量水平预期为剂量依赖和非线性清除;饱和剂量范围以上,预期为非剂量依赖和线性清除,清除率可预测。 由于生物效应的多样性,MABEL 法的终点指标(生物效应)并没有明确规定。药动学或控制生物体液、组织和作用位点中药物浓度的时间进程,与后续的药理学作用和大多数毒理学效应有关。在人体首次试验 MRSD估算时,通常根据动物PK/ PD 参数预测人体PK/ PD 参数的估算值,进而确定最小生物学效应剂量。由动物数据预测人体PK 时,线性PK抗体常用2 种方法:① 经验的异速缩放法,它是基于体重与PK 参数(V 或CL)之间的经典异速缩放原则,θ = a·Wb ,适用于种属间PK 参数转化的通式: w 为种属间转换的异速缩放指数。② 种属不变时间法(或Den⁃drick 基本作图法),其假设临床前种属中剂量标准化的药物浓度与人体相当,而动物的“PK⁃时间”则根据体重转化为人体的等效时间。该方法可以为特定剂量和剂量方案提供人体PK 概况预测。当单抗具有剂量依赖性的非线性清除PK 特性时,通常使用机制性方法,即,通过将Michaelis-Menten 方程合并到传统的双室模型中,采用靶标介导的药物处置(target MEDIATED DRUG DISPOSITION, TMDD)建模捕获抗体和抗原之间的动态相互作用[18] 。 清除过程(CL)的异速缩放指数为0. 75,器官大小或生理学容积(Vss,Vc 等)的异速缩放指数为1. 0,对于生理学时间或者生理学事件持续时间(如心率、呼吸持续时间、细胞寿命、内源性物质或过程的周转时间的异速缩放指数为0. 25[19] 。多数一般结构和功能的生理转化速率常数可以根据异速原则进行种属间预测,而能力(Emax)和灵敏度(EC 50)参数在种属间趋于相似。 Deng 等[20] 基于食蟹猴与人在解剖学、生理学和生物学上的相似性,包括FcRn 结合亲和力和抗体结合特异性,采用不同方法对具有线性PK 的13种治疗性单克隆抗体,由动物数据预测人体清除率进行了回顾性比较分析,建立了简化异速缩放法。采用PK 参数种属转换异速方程: BW h和BW c分别为人和猴子的体重,w 为CL的缩放指数。根据4 个抗体(训练集)观测到的CL h和CL c及猴子(3. 5 kg)与人的常规体重(70 kg)估算w 值,均值为(0. 831 ± 0. 042)(0. 776 ~ 0. 875);非线性混合效应模型估算的这4 个单抗的w 群体均值为0. 826,95%可信限[0. 805,0. 845],其余的9个单抗作为w 估算值的验证数据集,使用固定缩放指数0.85 计算 CLh,predicted 并与观测到的 CLh,observed 进行比较,预测百分误 100%均小于50%。最后,使用整个数据集中的13 个单抗体来确认w,均值为(0. 847 ±0. 07)(0.733 ~0. 970)。进一步证实由 CLc预测 CLh的固定指数为0.85。 结果表明,基于食蟹猴PK 数据和0. 85 指数异速缩放估算的人体CL与观测到的人体CL之间有较好的相关性,优于其他缩放方法。 3. 2 种属不变时间法(spices-invariant time meth-od, dedrick plots)预测人体血浆浓度⁃时间分布 种属不变时间法的基本思想源于异速法,其预测性能取决于各种属间药动学参数的异速关系。该方法基于如下假设:体重标准化的浓度和转换成生理时间生成的浓度⁃时间曲线,种属之间是重合的。将不同种属转换后的浓度⁃时间曲线叠加后再进行反向转换,得到预测的人体静脉浓度⁃时间分布。利用预测的人体静脉浓度⁃时间特征,与估算的平均吸收速率常数和生物利用度模拟人体经口给药的药动学概况[21] 。Deng 等[20] 的研究中,利用下述的种属不变时间法方程, CL采用固定指数0. 85,分布容积采用固定指数1. 0,将猴子静脉给予pertuzumab 5, 15 和50mg·kg -1后的单抗血清浓度⁃时间分布转化为人体浓度⁃时间分布,合理预测了人体的浓度⁃时间分布特征。
3. 3 机制性PK / PD 法估算人体PD / 初始剂量 Mager 等[22] 使用大鼠重组人红细胞生成素(rHuEpo)PK/ PD 模型预测人体内生物标志物:网织红细胞(RET)、红细胞计数(RBC)和血红蛋白(HGB)的时间进程。rHuEpo 在哺乳动物中表现出高度的同源性,在各种属中具有保守的生物学活性,其药理作用和敏感性参数基本上与种属无关。rHuEpo 在几种种属中的分布均为多指数和非线性的,典型的PK特征是两室模型,浓度依赖的 Michaelis-Menten 消除与线性非饱和清除通路并行。体内分布容积、清除率和一级速率常数按1,0.75 和-0.25 的异速指数进行缩放。RET,RBC 和平均红细胞血红蛋白(MCH)及其各自的个体间变异性(iuter-individual barrier, IIV)的基线值与药物和种属无关,以文献报道的人体值设置。RET,RBC 和细胞平均分化时间等寿命参数使用异速指数0. 124 来缩放,该指数是此前使用20 多个种属的RBC 数据估算的。3 种生物标志物的预测值与实测数据吻合较好,均在90% 的预测区间内。 HER2/ HER3 双特异性单抗MCLA-128 在食蟹猴中进行了PK 研究,但在小鼠JIMT⁃1 异种移植瘤研究中未进行PK 采样。Aurelia 等[23] ,利用MCLA-128 的食蟹猴PK 数据和小鼠JIMT⁃1 异种移植瘤模型中的肿瘤生长数据建立PK⁃PD 模型;采用异速缩放法进行种属间PK 参数转换,根据AUCs、受体占有率和PK⁃PD 模型,预测安全有效的临床剂量。首先,分别采用下列方程将食蟹猴PK 数据异速缩放到人体(体重以70 kg 计)的数据来预测MCLA-128在小鼠(体重以0. 02 kg 计)中浓度⁃时间分布并评估其与小鼠肿瘤生长的关系。
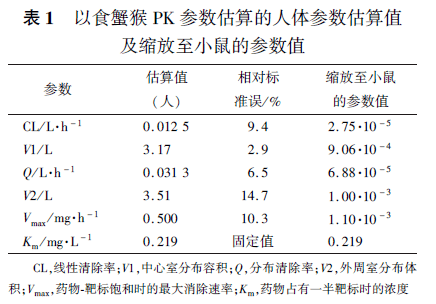
CL(线性清除率),Q(跨室清除率)和Vmax (最大消除速率)使用0. 75 的指数因子,V1(中心室分布容积)和V2(效应室分布容积)使用1 的指数因子。MCLA-128与食蟹猴与小鼠中表达人HER2 和HER3 移植肿瘤的HER2 和HER3 受体有完全交叉反应。因此,在人和小鼠参数估算时,没有对Km(0.219 mg·L -1)(药物占有一半靶标时的药物浓度)进行缩放,使用了食蟹猴的估算参数值。70 kg 人的参数估算值和计算得出的0.02 kg 小鼠缩放参数见表1。
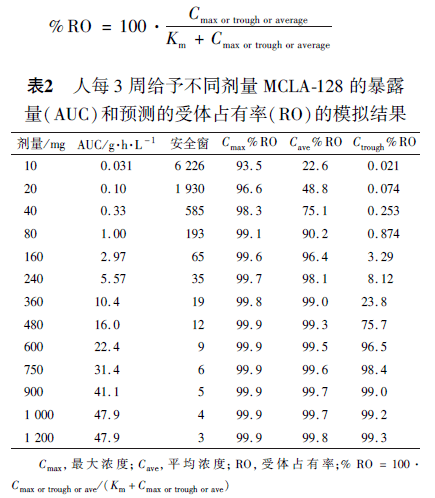
食蟹猴重复给药毒性研究中的 NOAEL为100mg·kg -1,单次给药毒性研究中100 mg·kg -1的AUC0-inf均值为193 g·h·L -1。193 g·h·L -1除以模型预测的人体AUC0-inf计算安全窗。根据预期的临床剂量,计算了预期最大(Cmax)、最低(Ctrough )和平均浓度(Cave )下的安全窗和受体占有率。公式如下:
10 ~480 mg 的临床剂量范围内,MCLA-128的安全窗> 10,360 mg 剂量C max和Cave 的RO 均高于99%。敏感性分析表明,不同的Km 值下,一直保持有充足的RO,160 mg(Km 值0. 021 9 mg·L -1) ~750 mg(Km 2. 19 mg·L -1)的RO 均高于99%;随后采用临床前PK⁃PD 模型对小鼠给予9.5, 20 和24 mg·kg -1,每周给药1 次,给药3 周肿瘤体积随时间的变化进行了模拟。这些剂量的AUCs 与人体首次试验(FIH)中360,750 和900 mg 等效剂量,每3 周给药1 次的模拟暴露量相当,预计人体在d 21 表现出明显的肿瘤生长停滞。 研究者认为,MCLA-12810 ~ 480 mg,每3 周给药1 次(q3w)的人体预测AUC 值至少较猴子NOA⁃EL 相应AUC 低10 倍。因此10 ~480 mg 剂量适合作为FIH 的起始剂量;根据受体占有率利用PK 模型确定药理学活性剂量,预计MCLA-128≥360 mg,q3w 给药,C max和Cavg的受体占有率超过99%,Ctrough为24%;最后,使用非临床PK⁃PD 模型对拟定的人体有效剂量进行了评价。结论:预计10 ~ 480 mgq3w 给药方案适合作为MCLA⁃128 首次人体研究的起始剂量。根据受体占有率和PK⁃PD 模型模拟,预计≥360 mg q3w 给药方案在人体中有效。 4 其他起始剂量计算方法 4. 1 类似药物比较法 如果可获得与研究药物类似药物的人体PK/ PD 数据时,可采用类似药物比较法[24 -25] 。 i 为研究药物参数,r 为类似药物参数。计算所得剂量通常使用一个人为的安全系数校正,以应对潜在的不确定性。 4. 2 药动学指导法 以 NOAEL值最低的种属作为缩放指标种属(认为是最敏感/ 最合适种属)。起始口服剂量是该药物在指标种属中的暴露量(AUC)和预测的人体清除率(CL)的乘积,由口服生物利用度(F)校正: 除AUC 外,稳态浓度(Css)或最大浓度(C max)也可作为系统暴露量[24,27] ,计算起始剂量: 这里τ 是给药间隔。Mahmood 等[28] 建议起始剂量计算中,使用清除率校正因子= 4. 3 体外生物试验外推法 Duff 等[29] 关于Ⅰ期临床试验的专家研究报告中, MABEL计算举例如下。 例1,0. 2 μg·mL -1浓度下体外测得的人血浆中最大抑制作用约为40%,2 或20 μg·mL -1浓度未见抑制程度的改变。计算的20% 抑制作用浓度为0. 01 μg·mL -1,使用50 mL·kg -1的人体血浆体积,将其转换成0. 01 μg·mL-1 ×50 mL·kg -1=0. 5 μg·kg -1的人体剂量。猴子的毒代动力学研究中,5 mL·kg -1推注的峰值血浆浓度为189 μg·mL -1。预计0.5 μg·kg -1剂量的血浆峰值浓度为0.018 9 μg·mL -1。起始剂量定为0. 5 μg·kg -1。 例2,体外试验中,某化合物与其啮齿动物同源物在亲和力和效力方面均无差异。2 种分子在啮齿动物疾病模型中均有效。试验化合物的最小有效剂量为0. 3 mg·kg -1,在啮齿类中的血浆水平为0. 04mg·mL -1。使用50 mL·kg -1的人体血浆体积,将其转化为人体的有效剂量= 0. 04 mg·mL-1 × 50 mL·kg -1=2 mg·kg -1。起始剂量为2 mg·kg -1。 受体相对亲和力与药物的体内药效估计有关,体外测量指标可用于不同种属 EC50值的缩放。Kal⁃vass 等[30] 在小鼠中对7 种阿片类药物进行的PK/PD 研究表明,药物在大脑中分布和结合的时间进程在确定其镇痛方面有重要作用。脑内未结合药物 EC50与体外受体结合亲和力(KD)呈良好的相关性。当缺乏完整的非临床研究数据、无法建立PK/PD 模型时, MABEL主要依据体外试验的平衡解离常数(KD)数据进行推算:RO = [C] / (KD + [C]),C为人体血浆中的药物浓度、KD 为受体配体平衡解离常数[31] 。一般采用20%的RO 来推算确定临床起始剂量,但是有时需要根据药物作用特点,选择更高或更低百分比的RO。 当以低RO 为目标确定起始剂量时,根据药物⁃受体相互作用平衡理论和已知的单抗PK 数据,研究专家组报告中提出了一种简化公式[29] 。假设药物量远远大于配基量,并具有快速的Kon - Koff速率,根据平衡结合亲和力(KD)计算RO,推导出的公式表明,KD /2 000(KD 以nmol·L -1表示) 的剂量(以mg·kg -1计算),其RO 为峰值的10%。然而,平衡公式并没有考虑复合物的转化率,因此预测效力是随着结合亲和力的增加而持续增加,亲和力较高则起始剂量较低。当复合物的转化率较受体的解离速率快时,据此推算的亲和力偏高,起始剂量偏低[32] 。 通过模拟也表明,许多大分子在受体上的解离速率较小分子慢,许多大分子靶标的转化率更高(如细胞因子),与血浆浓度比较许多单抗的组织浓度更低,在基于KD 的RO 计算中没有考虑这些因素,采用该种方法可能导致体内RO 的严重高估。这种过度预测可能会导致Ⅰ期剂量递增研究中多个无药理学活性的低剂量。 4. 4微剂量法[29] “微剂量”的定义,是指小于计算出的产生药理作用剂量的1/100。如产生药理学作用的剂量为5 mg·kg -1,其微剂量= 5 mg·kg -1×1/100 =0. 05 mg·kg -1。起始剂量为50 μg·kg-1。微剂量法均采用统一人为的安全系数,关于此方法对 MRSD估算准确性的报道较少,在剂量转化研究中并不常用。 5 小结与讨论 由动物实验PK 数据外推人体PK 数据均符合幂律,各种计算方法均是基于机体的生物学规律、药物在体内的动态过程及其与生物学效应的关系,对多个(同类)药物的动物和人体试验数据的回顾性分析,反推计算出缩放指数,然后使用该经验性缩放指数估算的人体预测值与临床观测值比较,验证缩放指数的合理性。各种方法均有其优缺点并且是相互关联的(表3),应根据文献或者药物特性选择合理的生物学参数和缩放指数。
NOAEL,MTD/ HNSTD, MABEL等各种方法均是基于机体对药物的处理、耐受特征和/ 或药物的药理作用性质,它们之间是互相关联的。药物的生物学效应广义上讲,应该包括药物的毒性作用和药理学作用,则 NOAEL和 MABEL等 MRSD估算方法均是基于候选药物的生物学效应,在小分子和大分子 MRSD预测中均具有价值。预测的准确性取决于药物的性质。如,对于靶向药物,尤其是靶向治疗性生物制品具有高效低毒的特点,与基于毒性作用的 NOAEL法相比, MABEL法可给出更准确的人体效应/ 剂量预测。基于PK⁃PD 模型的方法,更准确地捕捉了竞争性动态相互作用,是 MABEL剂量选择时优先考虑的。受体占有率(RO)可通过体外试验测定,可作为人体PK/ PD 模型的生物标志物。在估计起始剂量时,由于下游的生物学效应,建议对于具有激动作用的候选分子选择较低的RO 值,而对于具有拮抗作用的候选分子选择较高RO[33] 。 基于生理学的PBPK 预测方法由于其基于机制性原理而越来越多地得到应用,很多已有商业化软件,但是成功预测的关键是对药物性质、靶标生理性能的了解及参数的合理设定。建议同时使用 NOAEL, MABEL,PK 和PK/ PD 模型以及类似药物比较方法来获得几种估算剂量。随后,应评估所有毒理学、药理学、药动学和生物药学信息,以确定最佳FIH 剂量[34] 。剂量估算需要仔细考虑所有现有的资料,没有一种通用的方法适合于所有产品。 6 结语 随着国家鼓励创新战略决策的推进,中国医药行业正在进行由仿制药大国向创新药大国的转型。首次人体临床试验剂量选择是创新药研发的关键环节,如何由动物试验数据合理、准确预测人体首次最大推荐剂量,保证受试者安全的同时,减少无效递增剂量,节约临床试验资源,提高开发效率,是医药研发人员和监管机构需共同思考的问题。由于历史原因,我国医药研发中的转化医学经验不足。随着新技术、新产品的不断出现,将会面临更大的挑战。希望借助本文,对人体首次最大推荐剂量的概念和计算方法、各种考虑因素提供一份适用性参考,吸引更多的研发和评价人员关注该领域,促进我国创新药的健康发展。 参考文献 详见 中国新药杂志 2020年 第29卷第13 期 免责声明 我们尊重原创作品。选取的文章已明确注明来源和作者,版权归原作者所有,如涉及侵权或其他问题,请联系我们进行删除。 内容由凡默谷小编查阅文献选取,排版与编辑为原创。如转载,请尊重劳动成果,注明来源于凡默谷公众号。返回搜狐,查看更多 |
【本文地址】
| 今日新闻 |
| 推荐新闻 |
| 专题文章 |