| 高考化学丨沉淀溶解平衡知识点攻略! | 您所在的位置:网站首页 › ag和s2o3反应方程式 › 高考化学丨沉淀溶解平衡知识点攻略! |
高考化学丨沉淀溶解平衡知识点攻略!
|
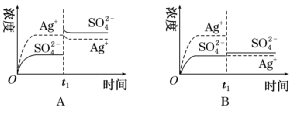
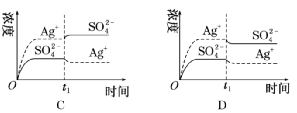
①碱溶解法。如用NaOH溶液溶解Al(OH) 3 ,化学方程式为NaOH+Al(OH) 3 NaAlO 2 +2H 2 O。 ②盐溶解法。除了酸、碱可以溶解难溶电解质,某些盐溶液也可用来溶解沉淀。如NH 4 Cl溶液可溶解Mg(OH) 2 。 ③配位溶解法。在难溶物中加入配位剂,因形成配合物而降低难溶物的某种离子浓度,使平衡右移,沉淀溶解。 ④氧化还原溶解法。有些金属硫化物(CuS、HgS等)不溶于非氧化性酸,只能溶于氧化性酸,通过减小 c(S 2 − )而达到沉淀溶解的目的。如3CuS+8HNO 3 (稀) 3Cu(NO 3 ) 2 +3S↓+2NO↑+4H 2 O。 (3)沉淀的转化 实质:沉淀溶解平衡的移动。 条件:两种沉淀的溶度积不同,溶度积大的可以转化为溶度积小的。 应用:锅炉除垢、矿物转化等。 题型一 沉淀溶解平衡的移动方向判断 已知Ag 2 SO 4 的 Ksp 为2.0×10 -5 ,将适量Ag 2 SO 4 固体溶于100 mL水中至刚好饱和,该过程中Ag + 和 浓度随时间变化关系如下图[饱和Ag 2 SO 4 溶液中 c(Ag + )=0.034 mol·L -1 ]。若t1 时刻在上述体系中加入100 mL 0.020 mol·L -1 Na 2 SO 4 溶液,下列示意图中,能正确表示 t1 时刻后Ag + 和SO 2-4浓度随时间变化关系的是
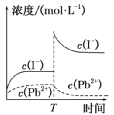
【答案】B 【解析】Ag2 SO 4 刚好为100 mL的饱和溶液,因为c(Ag + )=0.034 mol·L -1 ,所以 c( )=0.017 mol·L -1 ;当加入100 mL 0.020 mol·L -1 Na 2 SO 4 溶液后,c( )=0.018 5 mol·L -1 , c(Ag + )=0.017 mol·L -1 (此时Qc <Ksp )。由计算可知选B。 沉淀溶解平衡及其影响因素的理解 (1)沉淀溶解平衡是化学平衡的一种,沉淀溶解平衡的移动也同样遵循勒夏特列原理。 (2)沉淀溶解达到平衡时,再加入该难溶物对平衡无影响。 (3)难溶电解质的溶解过程有的是吸热过程,有的是放热过程。 (4)由于沉淀的生成取决于Qc 与Ksp 的相对大小,而溶解度与相对分子质量有关,有可能溶解度大的转化为溶解度小的。 (5)用沉淀法除杂不可能将杂质离子全部通过沉淀除去。一般认为残留在溶液中的离子浓度小于1× 10−5 mol·L −1 时,沉淀已经完全。 1.常温下,取一定量的PbI2 固体配成饱和溶液,T时刻改变某一条件,离子的浓度变化如图所示(注:第一次平衡时c(I- )=2×10-3 mol·L-1 , c(Pb 2+ )=1×10 -3 mol·L-1 ),下列有关说法正确的是
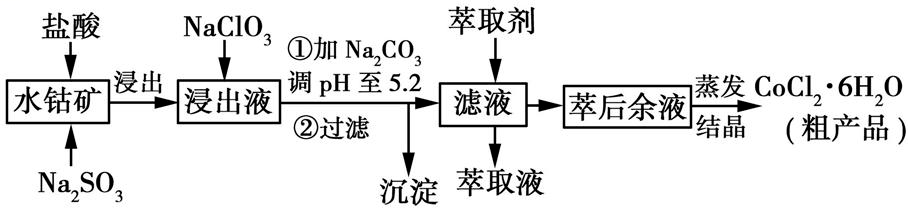
A.常温下,PbI 2 的Ksp =2×10 -6 B.温度不变,向PbI 2 饱和溶液中加入少量硝酸铅浓溶液,PbI2 的溶解度不变,Pb2+ 浓度不变 C.常温下Ksp (PbS)=8×10 -28 ,向PbI 2 的悬浊液中加入Na2 S溶液,PbI 2 (s)+S 2- (aq) PbS(s)+2I - (aq)反应的化学平衡常数为5×10 18 D.T时刻改变的条件是升高温度,PbI2 的Ksp 增大 【答案】C 【解析】由Ksp = c(Pb 2+ )· c2 (I - )=1×10-3 ×(2×10-3 ) 2 =4×10 -9 ,A错误;由于硝酸铅是强电解质,完全电离产生Pb 2+ ,温度不变,PbI2 的溶度积不变,但Pb2+ 浓度增大,B错误;PbI2 (s)+S 2- (aq) PbS(s)+2I- (aq)反应的平衡常数K=c2 (I - )/c(S 2- )= Ksp (PbI 2 )/ Ksp (PbS)=4×10 -9 /8×10-28 =5×10 18 ,C正确;T时刻若改变的条件是升高温度,c(Pb 2+ )、 c(I- )均呈增大趋势,D错误。 题型二 利用沉淀溶解平衡解决除杂和提纯问题 利用水钴矿[主要成分为Co2 O 3 和Co(OH)3 ,还有少量Fe2 O 3 、Al2 O 3 、MnO等]制取CoCl2 ·6H 2 O的工艺流程如图所示:
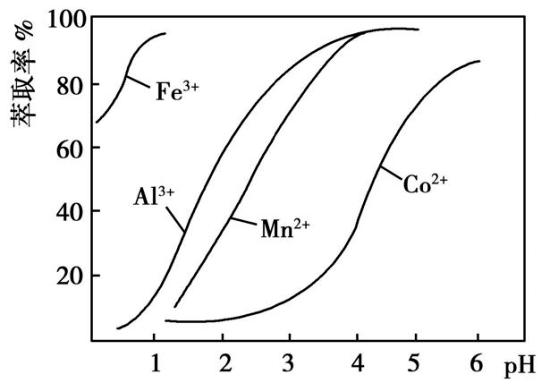
已知:①浸出液含有的阳离子主要有H+ 、Co2+ 、Fe2+ 、Mn2+ 、Al3+ 等: ②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表: 沉淀物 Fe(OH) 3 Fe(OH) 2 Co(OH) 2 Al(OH) 3 Mn(OH) 2 开始沉淀 2.7 7.6 7.6 4.0 7.7 完全沉淀 3.7 9.6 9.2 5.2 9.8 (1)写出浸出过程中Co2 O 3 发生反应的离子方程式。 (2)NaClO3 的作用是。 (3)加Na2 CO 3 调pH至5.2所得沉淀为。 (4)萃取剂对金属离子的萃取率与pH的关系如图所示。萃取剂的作用是;其使用的适宜pH范围是(填字母)。
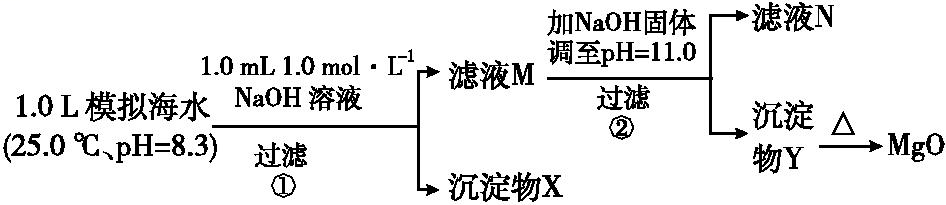
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5 (5)为测定粗产品中CoCl2 ·6H 2 O含量,称取一定质量的粗产品溶于水,加入足量AgNO 3 溶液,过滤、洗涤,将沉淀烘干后称其质量。通过计算发现粗产品中CoCl2 ·6H 2 O的质量分数大于100%,其原因可能是 (任答一条即可)。 【答案】(1)Co2 O 3 + +4H + 2Co 2+ + +2H 2 O (2)将Fe2+ 氧化成Fe3+ (3)Fe(OH)3 、Al(OH)3 (4)除去溶液中的Mn2+ B (5)粗产品含有可溶性氯化物或晶体失去部分结晶水 【解析】(1)浸出过程中,Co2 O 3 具有强氧化性,而具有强还原性,两者发生氧化还原反应生成Co2+ 和,离子方程式为Co2 O 3 + +4H + 2Co 2+ + +2H 2 O。 (2)由于浸出液含有Fe2+ ,为了使铁元素分离出来,依据题给表中信息知Fe(OH)3 开始沉淀的pH较小,故将加入NaClO3 把Fe2+ 氧化成Fe3+ 。 (3)从表中数据可以看出,当加Na2 CO 3 调pH至5.2时,所得沉淀为Fe(OH)3 、Al(OH)3 。 (4)根据题给的萃取剂对金属离子的萃取率与pH的关系图,利用萃取的方法可以把Mn2+ 提取出来而除去,即萃取剂的作用是除去溶液中的Mn2+ ;当pH=3.5,萃取率已很高,故其使用的适宜pH范围是3.0~3.5,即B项符合题意。 (5)由于粗产品含有可溶性氯化物,造成AgCl沉淀质量增加,按此计算所得粗产品中CoCl2 ·6H 2 O的质量分数可能大于100%,也可能是在沉淀烘干过程中晶体已失去部分结晶水,使粗产品的质量减少所致。 1.溶度积的计算 (1)已知溶度积求溶液中的某种离子的浓度,如 Ksp = a的饱和AgCl溶液中 c(Ag + )=a mol·L -1 。 (2)已知溶度积、溶液中某离子的浓度,求溶液中的另一种离子的浓度,如某温度下AgCl的 Ksp = a,在0.1 mol·L -1 的NaCl溶液中加入过量的AgCl固体,达到平衡后 c(Ag + )=10 amol·L-1 。 2.判断沉淀的生成、溶解及转化 通过比较溶液中有关离子浓度幂的乘积——离子积 Qc 与 Ksp 的相对大小,可以判断难溶电解质在给定条件下沉淀能否生成、溶解或转化。两溶液混合是否会产生沉淀或同一溶液中可能会产生多种沉淀时,判断产生沉淀先后顺序问题,均可利用溶度积的计算公式或离子积与溶度积的关系加以判断。 1.海水中含有丰富的镁资源。某同学设计了从模拟海水中制备MgO的实验方案:
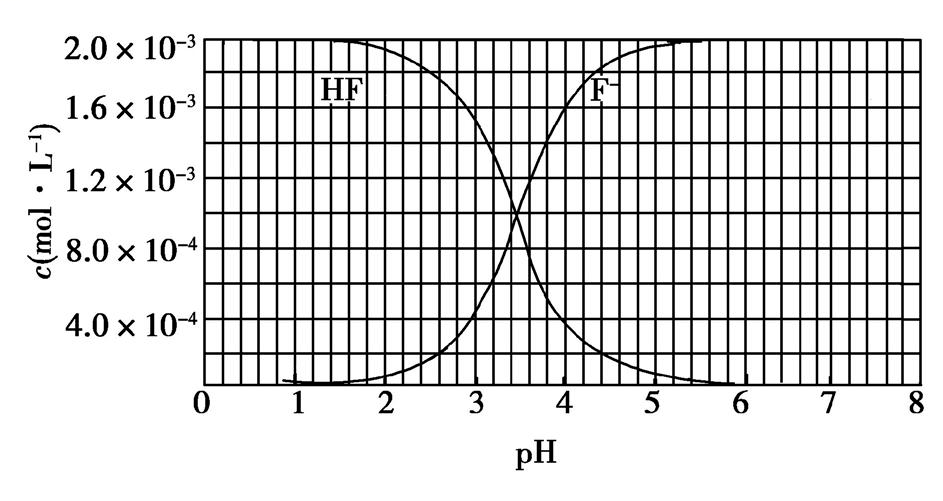
模拟海水中的离子浓度/(mol·L− 1 ) Na + Mg 2+ Ca 2+ Cl − HC 0.439 0.050 0.011 0.560 0.001 注:溶液中某种离子的浓度小于1.0×10 − 5 mol·L − 1 ,可认为该离子不存在;实验过程中,假设溶液体积不变。 Ksp (CaCO 3 )=4.96×10 − 9 , Ksp (MgCO 3 )=6.82×10 − 6 , Ksp [Ca(OH) 2 ]=4.68×10 − 6 , Ksp [Mg(OH) 2 ]= 5.61×10 − 12 。下列说法不正确的是 A.沉淀物X为CaCO 3 、MgCO 3 B.滤液M中存在Mg 2+ 、Ca 2+ C.滤液N中存在Ca 2+ ,没有Mg 2+ D.步骤②中若改为加入4.2 g NaOH固体,沉淀物Y为 Mg(OH) 2 ,没有Ca(OH) 2 【答案】A 【解析】步骤①,从题给的条件,可知n(NaOH)=0.001 mol,当1 L模拟海水中,加入0.001 moL NaOH时,OH − 恰好与完全反应生成0.001 mol ,由于Ksp (CaCO 3 ) ≪Ksp (MgCO 3 ),生成的 与水中的Ca2+ 反应生成CaCO3 沉淀:Ca2+ + CaCO 3 ↓,故沉淀物X为CaCO3 ,A不正确;步骤①中,由于只有0.001 mol,反应生成 CaCO3 所消耗的Ca2+ 也只有0.001 mol,滤液中还剩余 c(Ca 2+ )=0.010 mol·L −1 ,所以滤液M中同时存在着Ca2+ 和Mg2+ ,B正确;步骤②,当滤液M中加入NaOH固体,调至pH=11.0时,此时滤液中c(OH − )=1×10 −3 mol·L −1 。则Qc [Ca(OH) 2 ]= c(Ca 2+ )×(10 −3 ) 2 =0.010×(10 −3 ) 2 =10 −8 Ksp [Ca(OH) 2 ],无Ca(OH) 2 生成,Qc [Mg(OH) 2 ]= c(Mg 2+ )×(10 −3 ) 2 =0.050×(10 −3 ) 2 =5×10 −8 > Ksp [Mg(OH) 2 ],有Mg(OH) 2 沉淀生成,又由于Ksp [Mg(OH) 2 ]= c(Mg 2+ )×(10 −3 ) 2 =5.61×10 −12 ,c(Mg 2+ )=5.61×10 −6 mol·L −1 −5 mol·L −1 ,无剩余,滤液N中不存在Mg2+ ,C正确;步骤②中若改为加入4.2 g NaOH固体,则 n(NaOH)=0.105 mol,与0.05 moL Mg 2+ 反应:Mg2+ +2OH − Mg(OH) 2 ↓,生成0.05 mol Mg(OH)2 ,剩余 0.005 mol OH− ,由于Qc [Ca(OH) 2 ]= c(Ca 2+ )× c2 (OH − )=0.010×(0.005) 2 =2.5×10 −7 Ksp [Ca(OH) 2 ],所以无Ca(OH) 2 沉淀析出,沉淀物Y为Mg(OH)2 沉淀,D正确。 2.某硫酸工厂的酸性废水中砷(As)元素含量极高,为控制砷的排放,可采用化学沉降法处理含砷废水,相关数据如下表。请回答以下问题: 表1 几种盐的 Ksp 难溶物 Ksp Ca 3 (AsO 4 ) 2 6.8×10 -19 CaSO 4 9.1×10 -6 FeAsO 4 5.7×10 -21 表2 工厂污染物排放浓度及允许排放标准 污染物 H 2 SO 4 As 废水浓度 29.4 g·L -1 1.6 g·L -1 排放标准 pH=6~9 0.5 mg·L -1 (1)该硫酸工厂排放的废水中硫酸的物质的量浓度c(H 2 SO 4 )= mol·L -1 。 (2)若酸性废水中Fe 3+ 的浓度为1.0×10 -4 mol·L -1 ,则 c()=mol·L -1 。 (3)工厂排放出的酸性废水中的三价砷(弱酸H 3 AsO 3 )不易沉降,可投入MnO 2 先将其氧化成五价砷 (弱酸H 3 AsO 4 ),此时MnO 2 被还原为Mn 2+ ,该反应的离子方程式为 。 (4)在处理含砷废水时采用分段式,先向废水中投入生石灰调节pH到2,再投入生石灰将pH调节到8左右,使五价砷以Ca 3 (AsO 4 ) 2 的形式沉降。 ①将pH调节到2时废水中有大量沉淀产生,沉淀主要成分的化学式为 。 ② Ca 3 (AsO 4 ) 2 在pH调节到8左右才开始沉淀,原因为 。 ③砷酸(H 3 AsO 4 )分步电离的平衡常数(25 ℃)为 Ka1 =5.6×10 -3 , Ka2 =1.7×10 -7 , Ka3 =4.0×10 -12 ,第三步电离的平衡常数表达式为 Ka3 = ,Na 3 AsO 4 第一步水解的离子方程式为 +H 2 O +OH - ,该步水解的平衡常数(25 ℃)为 。 【答案】(1)0.3 (2)5.7×10-17 (3)2H+ +MnO 2 +H 3 AsO 3 H 3 AsO 4 +Mn 2+ +H 2 O (4)①CaSO 4 ②H 3 AsO 4 是弱酸,当溶液pH调节到8左右,c()增大,容易形成Ca 3 (AsO 4 ) 2 沉淀或pH增大,促进 H3 AsO 4 电离,c() 增大,Qc = c3 (Ca 2+ )· c2 ( )>Ksp [Ca 3 (AsO 4 ) 2 ],Ca 3 (AsO 4 ) 2 才开始沉淀 ③2.5×10 -3 【解析】(1)c(H 2 SO 4 )= =0.3 mol·L -1 。(2)c()=mol·L -1 =5.7×10 -17 mol·L -1 。(3)利用化合价升降原理配平相关方程式,即可得出离子方程式为2H+ +MnO 2 +H 3 AsO 3 H 3 AsO 4 +Mn 2+ +H 2 O。(4) ①由于H2 SO 4 是强酸,废水中c(S)较大,所以当pH=2时,生成的沉淀为CaSO 4 。②H 3 AsO 4 为弱酸,当pH较小时,抑制了H3 AsO 4 的电离,c()较小,不易形成Ca 3 (AsO 4 ) 2 沉淀,当pH≈8时,的浓度增大,容易形成Ca3 (AsO 4 ) 2 沉淀。③H 3 AsO 4 的第一步电离为H3 AsO 4 H + +H 2 As ,第二步电离为H2 As H + + ,第三步电离为H + + ,Ka3 = 。第一步水解的平衡常数Kh = =====2.5×10 -3 。 题型三 沉淀溶解平衡与溶液中其他平衡的综合应用 已知:①25 ℃时,弱电解质的电离平衡常数:Ka (CH 3 COOH)=1.8×10 -5 mol·L -1 ,Ka (HSCN)=0.13 mol·L -1 ;难溶电解质的溶度积常数:Ksp (CaF 2 )=1.5×10 -10 mol 3 ·L -3 。 ②25 ℃时,2.0×10 -3 mol·L -1 氢氟酸中,调节溶液的pH(忽略体积变化),得到c(HF)、c(F - )随溶液pH的变化如图所示:
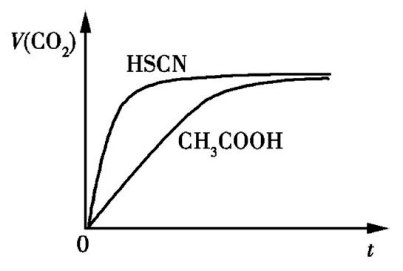
请根据以上信息回答下列问题: (1)25 ℃时,将20 mL 0.10 mol·L-1 CH 3 COOH溶液和20 mL 0.10 mol·L -1 HSCN溶液分别与20 mL 0.10 mol·L -1 NaHCO 3 溶液混合,实验测得产生的气体体积(V)随时间(t)变化的示意图如图所示。
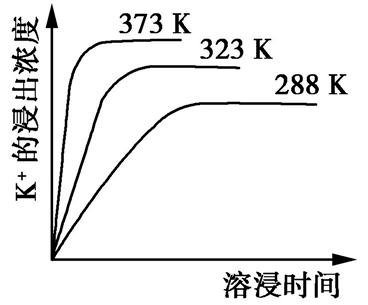
反应初始阶段,两种溶液产生CO2 气体的速率存在明显差异的原因是,反应结束后所得两溶液中,[CH3 COO - ] [SCN - ](填“>”、“ (2)25 ℃时,HF的电离平衡常数的数值Ka ≈ ,列式并说明得出该平衡常数的理由。 (3)4.0×10-3 mol·L -1 HF溶液与4.0×10 -4 mol·L -1 CaCl 2 溶液等体积混合,调节混合液的pH为4.0(忽略调节时混合液体积的变化),通过列式计算说明是否有沉淀产生。 【答案】(1)HSCN的酸性比CH3 COOH的强,其溶液中[H + ]较大 (2)10-3.45 mol·L -1 (或3.5×10 -4 mol·L -1 ) Ka = ,当[F- ]=[HF]时, Ka =[H + ],图中的交点处即为[F - ]=[HF],故所对应的pH即为 Ka 的负对数 (3)由题图知,当pH=4.0时,溶液中的c(F - )=1.6×10 -3 mol·L -1 ,c(Ca 2+ )=2.0×10 -4 mol·L -1 ,c(Ca 2+ ) c2 (F - )≈5.1×10 -10 mol 3 ·L -3 > Ksp (CaF 2 ),有沉淀产生。 【解析】由题给数据可知,相同条件下,HSCN的酸性比CH3 COOH的强,则等体积、等浓度时,HSCN溶液中的[H + ]比CH 3 COOH溶液中的大,反应速率大,最终均与NaHCO 3 完全反应,得到CH3 COONa溶液和NaSCN溶液,酸性越弱,弱酸酸根离子的水解程度越大,所以反应后的溶液中,[CH 3 COO - ] - ]。 解答溶液综合性问题时,首先明确涉及哪些知识;其次它们之间有何联系;第三结合题给信息进行灵活应答。 1.已知难溶性物质K 2 SO 4 ·MgSO 4 ·2CaSO 4 在水中存在如下平衡:K 2 SO 4 ·MgSO 4 ·2CaSO 4 (s) 2Ca 2+ (aq)+2K + (aq)+Mg 2+ (aq)+4 (aq),不同温度下,K + 的浸出浓度与溶浸时间的关系如图所示,则下列说法错误的是
A.向该体系中加入NaOH饱和溶液,溶解平衡向右移动 B.向该体系中加入碳酸钠饱和溶液,溶解平衡向右移动 C.升高温度,反应速率增大,平衡向右移动 D.该平衡的Ksp = c(Ca 2+ )· c(K 2+ )· c(Mg 2+ )· c() 【答案】D 【解析】A项,已知K2 SO 4 ·MgSO 4 ·2CaSO 4 (s) 2Ca 2+ (aq)+2K + (aq)+Mg 2+ (aq)+4 (aq),加入NaOH饱和溶液,OH - 和Mg2+ 结合生成Mg(OH)2 沉淀,c(Mg 2+ )减小,溶解平衡右移,正确;B项,加入碳酸钠饱和溶液, 和Ca2+ 结合生成CaCO3 沉淀,c(Ca 2+ )减小,溶解平衡右移,正确;C项,由图可知,升高温度,反应速率增大,且 c(K + )增大,说明平衡右移,正确;D项,K 2 SO 4 ·MgSO 4 ·2CaSO 4 (s) 2Ca 2+ (aq)+2K + (aq)+Mg 2+ (aq)+4 (aq),则该平衡的Ksp = c2 (Ca 2+ )· c2 (K + )· c(Mg 2+ )· c4 ( ),错误。返回搜狐,查看更多 |
【本文地址】