| 化学小组实验探究SO2与AgNO3溶液的反应。(1)实验一:用如下装置(夹持、 | 您所在的位置:网站首页 › agno3和na2s2o3反应关于na2s203结论 › 化学小组实验探究SO2与AgNO3溶液的反应。(1)实验一:用如下装置(夹持、 |
化学小组实验探究SO2与AgNO3溶液的反应。(1)实验一:用如下装置(夹持、
|
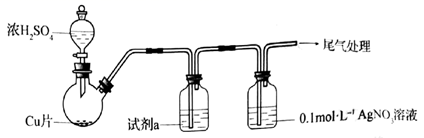
化学小组实验探究SO2与AgNO3溶液的反应。 (1)实验一:用如下装置(夹持、加热仪器略)制备SO2,将足量SO2通入AgNO3溶液中,迅速反应,得到无色溶液A和白色沉淀B。
①浓H2SO4与Cu反应的化学方程式是____________________________________。 ②试剂a是____________。 (2)对体系中有关物质性质分析得出:沉淀B可能为 实验二:验证B的成分
①写出Ag2SO3溶于氨水的离子方程式:__________。 ②加入盐酸后沉淀D大部分溶解,剩余少量沉淀F。推断D中主要是BaSO3,进而推断B中含有Ag2SO3。向滤液E中加入一种试剂,可进一步证实B中含有Ag2SO3。所用试剂及现象是__________。 (3)根据沉淀F的存在,推测 途径1:实验一中,SO2在AgNO3溶液中被氧化生成Ag2SO4,随沉淀B进入D。 途径2:实验二中, 实验三:探究 ①向溶液A中滴入过量盐酸,产生白色沉淀,证明溶液中含有________:取上层清液继续滴加BaCl2溶液,未出现白色沉淀,可判断B中不含Ag2SO4。做出判断的理由:_______。 ②实验三的结论:__________。 (4)实验一中SO2与AgNO3溶液反应的离子方程式是_________________。 (5)根据物质性质分析,SO2与AgNO3溶液应该可以发生氧化还原反应。将实验一所得混合物放置一段时间,有Ag和 (6)根据上述实验所得结论:__________________。 答案 Cu+2H2SO4(浓) 【解析】 本题的实验目的是探究SO2与硝酸银溶液的反应,实验过程先用铜片和浓硫酸反应制备SO2,再将SO2通入硝酸银溶液中,对所得产物进行探究,可依据元素化合物知识解答。 【详解】 (1)①铜和浓硫酸在加热的条件下反应生成硫酸铜、二氧化硫和水,化学方程式为:Cu+2H2SO4(浓) 故答案为Cu+2H2SO4(浓) ②由于烧瓶中的空气没有排出,反应生成的SO2可能会被氧气氧化为SO3,SO3会干扰后续的实验,所以试剂a应为除去杂质SO3的试剂,可以用饱和NaHSO3溶液; 故答案为饱和NaHSO3溶液; (2)①Ag2SO3溶于氨水得到Ag(NH3)2+,离子方程式为:Ag2SO3+4NH3•H2O=2 Ag(NH3)2++SO32-+4H2O, 故答案为Ag2SO3+4NH3•H2O=2 Ag(NH3)2++SO32-+4H2O; ②推测沉淀D为BaSO3,加过量稀盐酸溶解得滤液E和少量沉淀F,则E中可能含有溶解的SO2,可加入双氧水溶液,若加入双氧水溶液可以将亚硫酸或亚硫酸根离子氧化为硫酸根离子,从而生成白色的硫酸钡沉淀,则证明B中含有Ag2SO3; 故答案为H2O2,溶液,产生白色沉淀,则证明B中含有Ag2SO3; (3)①加入过量盐酸产生白色沉淀,说明含有Ag+;B中不含Ag2SO4,因若含有Ag2SO4,加入BaCl2溶液会生成难溶的BaSO4白色沉淀, 故答案为Ag+;因若含有Ag2SO4,加入BaCl2溶液会生成难溶的BaSO4白色沉淀; ②实验三的结论:实验一中,SO2在AgNO3溶液中未被氧化生成Ag2SO4;实验二中,SO32-被氧化为SO42-; (4)根据以上分析,二氧化硫与硝酸银溶液反应生成亚硫酸银沉淀,离子方程式为:2Ag++SO2+H2O= Ag2SO3+2H+, 故答案为2Ag++SO2+H2O= Ag2SO3+2H+; (6)综合实验一、实验二和实验三的分析,可以得出该实验的结论为:二氧化硫与硝酸银溶液反应生成亚硫酸银的速率大于生成银和硫酸根离子的速率,碱性溶液中亚硫酸根离子更易被氧化为硫酸根离子。 故答案为二氧化硫与硝酸银溶液反应生成亚硫酸银的速率大于生成银和硫酸根离子的速率,碱性溶液中亚硫酸根离子更易被氧化为硫酸根离子。 |
【本文地址】