| WB、ELISA、IHC 三大实验,这一篇全搞定 | 您所在的位置:网站首页 › WB一抗稀释倍数过高会不会影响结果 › WB、ELISA、IHC 三大实验,这一篇全搞定 |
WB、ELISA、IHC 三大实验,这一篇全搞定
|
师妹 奇怪,用了师兄的方法,还是做不出满意的结果。 每个人做实验的习惯方法千差万别,其实你只需要学习一套标准的实验流程就 ok 啦。
BOSTER 免疫印迹(WB)、免疫组化(IHC)、酶联免疫吸附试验(ELISA),是免疫学三大常用工具,分别应用于定位、定性和定量。 博士德历经 27 年的技术钻研,作为一枚资深实验专家,特别能理解初入门的实验员,为了帮助初学者快速上手,减少摸索的苦恼,博士君专门为大家准备了一套标准的实验流程和技巧,有了这篇纯干货,相信大家就能轻松搞定各种疑难杂症,一路从实验小白进阶为实验达人。 + 免疫印迹(WB)
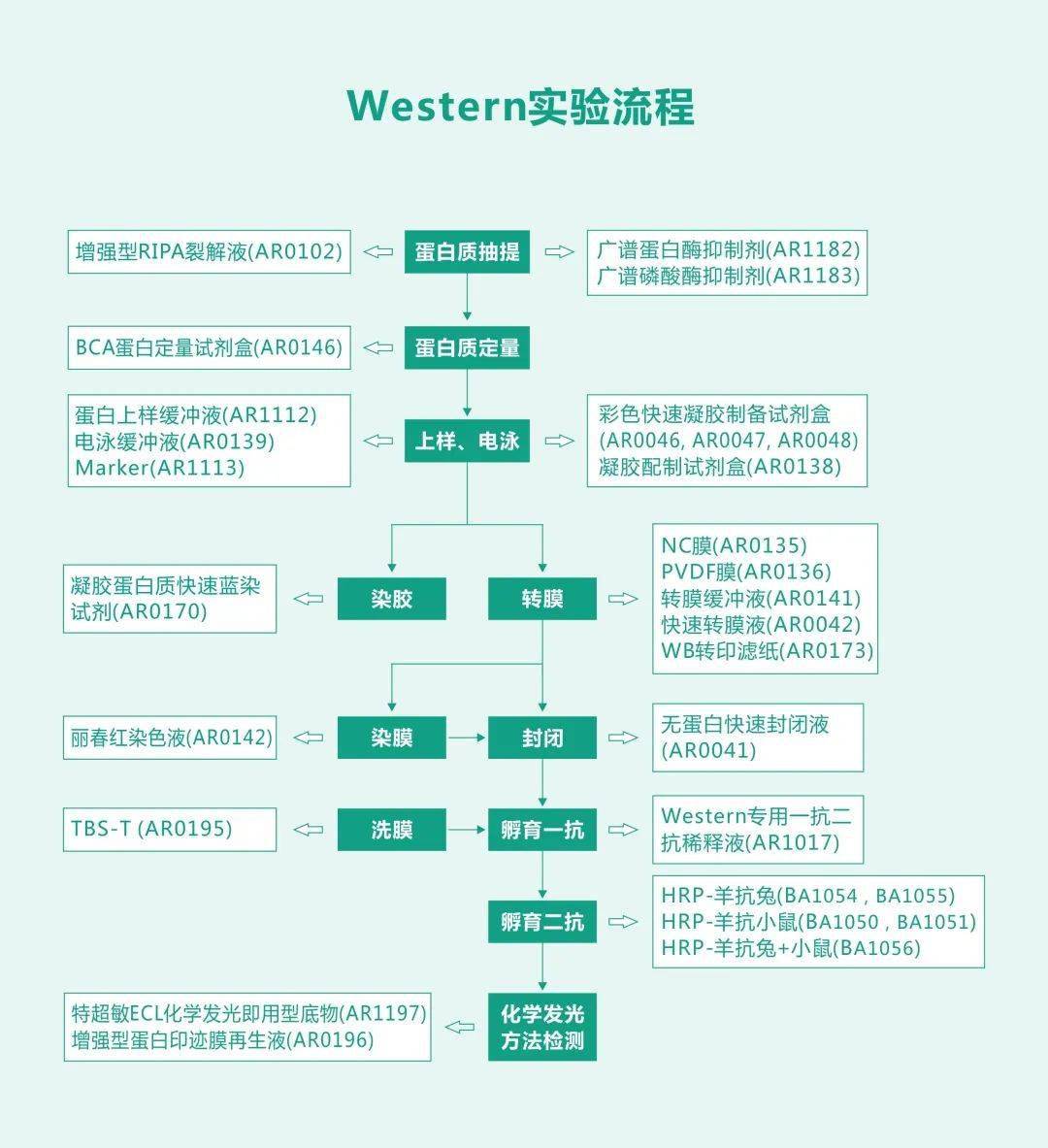
■ WB 简介 先要进行 SDS-PAGE,然后将分离开的蛋白质样品用电转仪转移到固相载体上,而后利用抗原-抗体-标记物显色来检测样品,可以用于定性和半定量。 实验流程
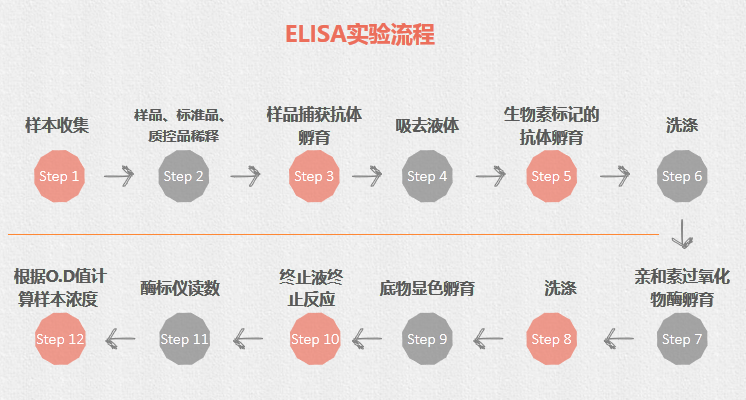
操作视频 常见问题 高背景 原因 解决办法 抗体浓度太高 优化/降低一抗和二抗的浓度 抗体孵育温度过高 4 ℃ 孵育 二抗非特异性结合或与封闭剂交叉反应 设置二抗对照(不加一抗),降低二抗浓度 一抗或二抗与封闭剂有交叉反应 在孵育和洗涤液中加入 Tween-20 减少交叉反应. 封闭不充分 延长封闭时间,更换合适的封闭剂(脱脂奶粉,BSA,酪蛋白等) 抗体与其它蛋白质交叉反应 更换不同的封闭液;勿在含生物素体系中使用脱脂奶粉封闭;降低二抗浓度;检测二抗与膜的交叉反应性 洗膜不充分 增加洗涤次数 膜干燥 保证充分的反应液,避免出现干膜现象 信号弱或无信号 原因 解决办法 抗体 增加抗体浓度;更换有效抗体(抗体失效) 抗原不足 增加上样量 抗原被封闭液遮蔽 试用不同的封闭液 ;优化封闭液中蛋白质浓度 ;缩短封闭时间 蛋白质样品在储存过程中降解 重新制备样品 转膜不充分,或洗膜过度 使用丽春红检测转膜效果,PVDF 膜需浸透,需正确的转膜操作,勿过度洗膜 过度封闭 使用含 0.5% 脱脂奶或无脱脂奶的抗体稀释液,或更换封闭剂,减少封闭时间 一抗失效 使用有效期内抗体,分装保存,避免反复冻融取用, 工作液现配现用 酶和底物失效 直接将酶和底物进行混合,如果不显色则说明酶失活了。选择在有效期内、有活性的酶联物,使用新鲜的底物. 非特异性条带 原因 解决办法 一抗浓度过高 在满足一定的敏感性的情况下,降低一抗浓度 二抗引起的非特异条带 免疫球蛋白是一个超家族,而标本中含有大量的类似球蛋白的抗原,容易和二抗引起反应,尤其是在变性的情况下,在满足敏感性要求的前提下,更换为其它种属来源的二抗,如驴二抗,羊驼二抗等 蛋白的降解 同前 上样量过高 适当减少上样量 洗涤不完全 可适当延长洗涤时间 封闭不好 延长封闭的时间;选择更加适合的封闭液 弥散型条带 原因 解决办法 抗体浓度太高 降低抗体浓度 蛋白质上样量太多 降低蛋白质上样量 迁移过快、电泳温度过高 降低电泳速度,低温电泳(冷室) 扫码查看 WB 直播课 (内附课件资料) + 酶联免疫吸附试验(ELISA) ■ ELISA 简介 用到了免疫学原理和化学反应显色,需要将抗原或抗体结合到固相载体表面,从而使后来形成的抗原-抗体-酶-底物复合物粘附在载体上,这就是 「吸附」的含义。 实验流程
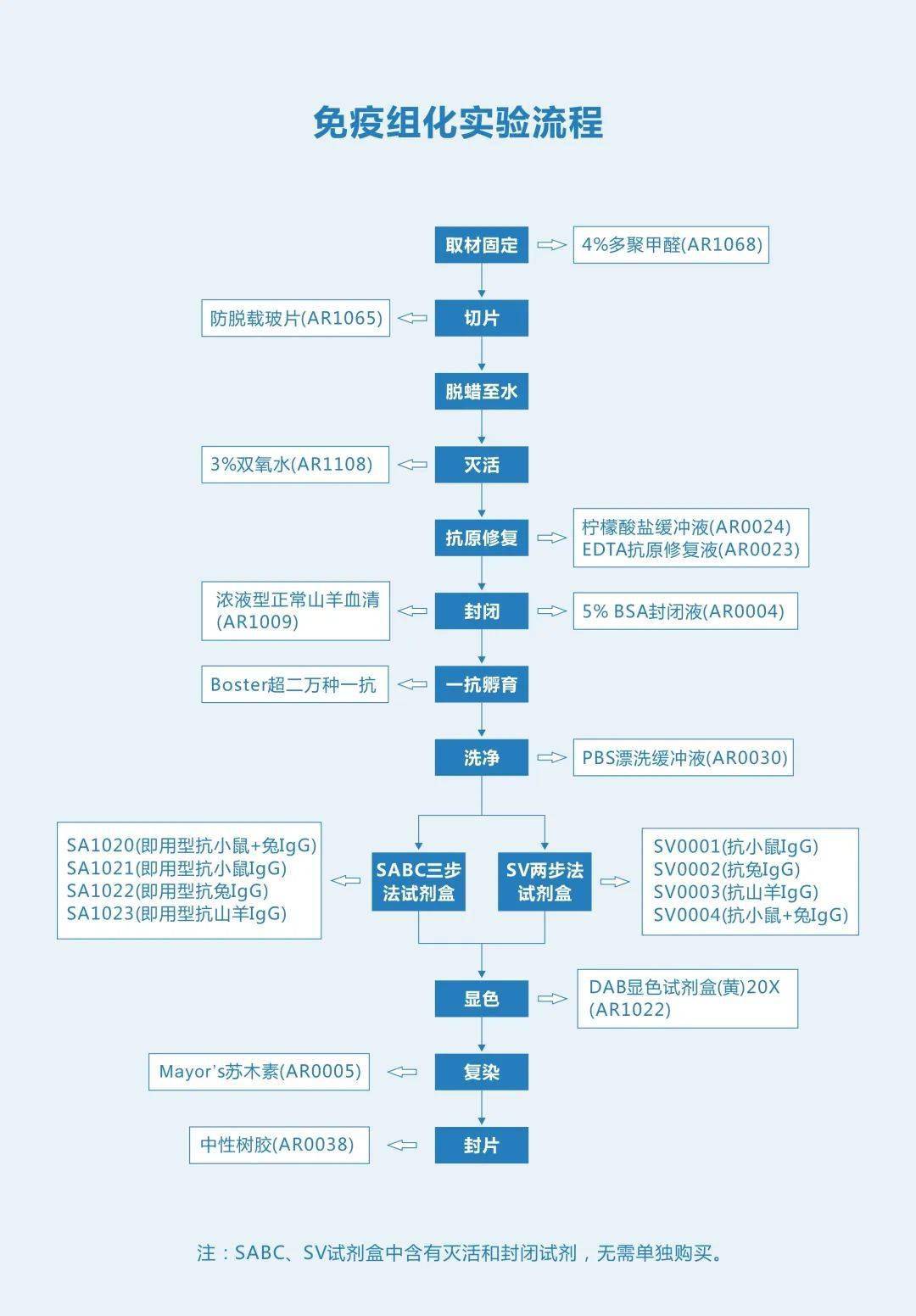
操作视频 注意事项 1. 样本收集 每个标本量收集体积=100 μL×检测种类,如要做复孔,标本量收集体积=100 μL×检测种类×2。对收集后当天进行检测的标本,储存在 4 ℃ 备用,如有特殊原因需要周期收集标本,将标本及时分装后放在 -20 ℃ 或 -70 ℃ 条件下保存,避免反复冻融。标本 2~8 ℃ 可保存 48 小时,-20 ℃ 可保存1个月。-70 ℃ 可保存 6 个月。部分激素类标本需添加抑肽酶。如需离心的样本,离心转速不宜过高(2,000-3,000) 2. 样品、标准品、质控品稀释 加完样本稀释液溶解标准品后应混匀放置室温 10~15 min 后再开始梯度稀释标准品 3. 样品捕获抗体孵育 37 ℃ 恒温孵育,避免温度变化过大 4. 生物素标记的抗体加入及孵育 生物素标记的抗体需用抗体稀释液按 1:100 配制,在加入 96 孔板前 2 小时内准备,37 ℃ 恒温孵育,避免温度变化过大 5. 洗涤 机洗:将 25X 洗涤缓冲液稀释成 1X,1X 洗涤缓冲液洗三次,每次加 300 μL 浸泡 60 s 手洗:手洗次数应比机洗次数多,浸泡时间也应适当延长*手洗容易导致吸附在酶标板底部的试剂脱落,从而导致结果偏小,手洗次数过多也会影响实验结果,建议机洗 6. 亲和素过氧化物酶(ABC)加入及孵育 ABC 在加入酶标板前 1 个小时内用 ABC 稀释液按 1:100 配制,使用前应放至室温平衡 30 min 7. 底物显色(TMB 显色)孵育 TMB 在使用前应放置室温平衡 30 min,加的量为 90 μL 8. 终止液终止反应 加完 TMB 终止液应让其混匀再在酶标仪上读数 9. 酶标仪读数 在 450 nm 波长处测定 O.D 值 10. 根据 O.D 值计算样本浓度 使用 CurveExpert 软件拟合标准曲线,根据标准曲线的拟合度(r 或 R2)以及残差平方和(s)选择合适的曲线 常见问题 1.ELISA 试剂盒可以检测哪些类型的标本? 我们的大多数 ELISA 试剂盒均适用于血清,血浆,细胞培养上清液和其它体液。在产品说明书和我们的目录上您会看到具体的适用范围。 2.样本为什么需要稀释? 1)在一些测试中,样本的读数高于标准曲线,为了得到更加准确的结果,需使分析物的含量在测定范围内,因此需要稀释;2)以降低非特异性反应,使特异性的抗原抗体反应充分体现出来。 3.背景色过高主要有哪些原因? 原因 解决办法 不正确的洗涤:洗涤不充分或省略洗涤步骤中的任何一步均会导致背景色过高 检查洗涤缓冲液的体积并确保完成所有的洗涤步骤;确保洗涤缓冲液的正确稀释和正确使用。 底物污染:在实验时留存一些额外的底物,底物本身不应该有颜色 确保在使用前,底物不被金属离子或氧化剂污染 底物曝光:底物曝光会使底物变成蓝色 在加入板内之前要保存在暗处(即试剂瓶内) ABC 的错误稀释 ABC 浓度过高会造成高背景色,因此要严格按照产品说明书稀释 孵育时间和温度不对 必须严格按照产品说明书来确定孵育时间和温度 4.梯度稀释时出现跳孔现象主要有哪些原因? 原因 解决办法 酶标板叠放 避免酶标板叠放 梯度稀释时不准确 确定移液枪精准,梯度稀释正确 蒸发 封闭时加封板膜或盖板 酶标板底部有杂物或水珠 加试剂时确保酶标板底部干净 扫码查看 ELISA 直播课 (内附课件资料) + 免疫组化(IHC) ■ IHC 简介 融合了免疫学原理 (抗原抗体特异性结合) 和组织学技术 (组织的取材、固定、包埋、切片、脱蜡、水化等),通过化学反应使标记抗体的显色剂 (荧光素、酶、金属离子、同位素) 显色,来对组织 (细胞) 内抗原进行定位、定性及定量的研究 (主要是定位)。 实验流程
操作视频 注意事项 1.组织取材 为避免蛋白丢失及组织受损引起的非特异试剂吸附,取材须快速(组织块也不宜太大)且要尽量避免人为损伤。 2.固定 固定要及时、彻底,但也不能固定过久。实验证明甲醛固定时间越久的组织越容易出现自发荧光及非特异性染色。一般以 12~36 小时最好。 3.石蜡片与冰冻片的选择 石蜡片制作对设备要求较冰冻片低,组织结构更好,保存条件简单时间也久。但对部分蛋白有较强烈的破坏作用,对蛋白保护较冰冻片差。冰冻片对蛋白的保护较石蜡片好,制作起来也较快。 4.灭活 过氧化物酶(HRP)系统的一定要做内源性过氧化物酶的灭活,而对于碱性磷酸酶(AP)系统和免疫荧光这个步骤不需要做。 5.抗原修复 不同的样本、不同的蛋白其最佳的抗原修复方式会有所区别,热修复(酸性修复液(柠檬酸盐修复液)、碱性修复液(EDTA 修复液))及酶修复(蛋白酶)都可做尝试。对于陈旧的样本要增加修复强度,比如延长修复时间。 6.封闭 常用的封闭液有 5% BSA 和血清。BSA 是通用型的封闭液。血清应选择与二抗同源的血清。 7.抗体孵育 一抗一定要与实验及样本匹配的,孵育条件以 4 ℃ 过夜最佳。二抗应匹配一抗, 37 ℃ 孵育半小时即可。 8.显色 DAB 显色建议在镜下控制反应时间,在阳性及背景之间选择平衡点。 9.结果观察 建议在数据库中查询准确的表达部位,比如 https://www.uniprot.org/ https://www.proteinatlas.org/ 常见问题 1.无染色 原因 解决办法 一抗和二抗不匹配 使用针对一抗的二抗(如一抗来自兔,二抗为抗兔抗体) 没有足够的一抗与目标蛋白结合 提高一抗用量。延长 4 ℃ 孵育时间(如过夜) 由于不当储存、稀释或反复冻融造成一抗/二抗试剂盒失效 做阳性对照确认一抗/二抗试剂盒的有效性 样本中没有目标蛋白 建议做阳性对照 目标蛋白含量太少 应用信号放大操作 脱蜡不彻底 延长脱蜡时间,更换二甲苯 缩短固定时间,加强抗原修复 蛋白位于细胞核内(核蛋白),抗体不能穿透核膜 对样本进行破膜通透处理 PBS 缓冲液被细菌污染后破坏了靶蛋白的磷酸根 在抗体 PBS 储存液中加入适量防腐剂,或使用新鲜无菌的 PBS 2.高背景 原因 解决办法 封闭不充分 选择合适的封闭液,延长封闭时间 一抗浓度过高 针对一抗做浓度梯度实验,选择合适浓度 孵育温度过高,时间过长 选择 4 ℃ 过夜或缩短孵育时间 二抗质量不佳 不加一抗,做二抗对照,选择合格二抗 组织冲洗不彻底 加强洗涤 内源性过氧化物酶含量过高 延长 3% H 2 O 2 灭活时间或用 0.5% 高碘酸溶液室温孵育 10 min 固定过度 改变抗原修复方法或减小抗原修复强度。 信号过度放大 缩短抗体孵育时间 通透作用破坏膜并除去了膜蛋白 去除缓冲液中的通透剂 显色底物过量或显色时间太长 缩短底物孵育时间 3.非特异性染色 原因 解决办法 一抗/二抗浓度过高 降低抗体浓度和或缩短孵育时间 存在内源性过氧化物酶活性 延长 3% H 2 O 2 灭活时间或用 0.5% 高碘酸溶液室温孵育 10 min 一抗与被染组织同源(如用鼠一抗检测鼠组织),加二抗后,二抗会与同源的所有组织结合 应用与组织非同源的一抗 切片/细胞变干 保持切片/细胞湿度,切勿变干。 扫码查看 IHC 直播课 (内附课件资料)
图文来源:BOSTER 题图来源:站酷海洛返回搜狐,查看更多 |
【本文地址】