| 从作用机制,到循证证据 | 您所在的位置:网站首页 › VMware中安装win10教程 › 从作用机制,到循证证据 |
从作用机制,到循证证据
|
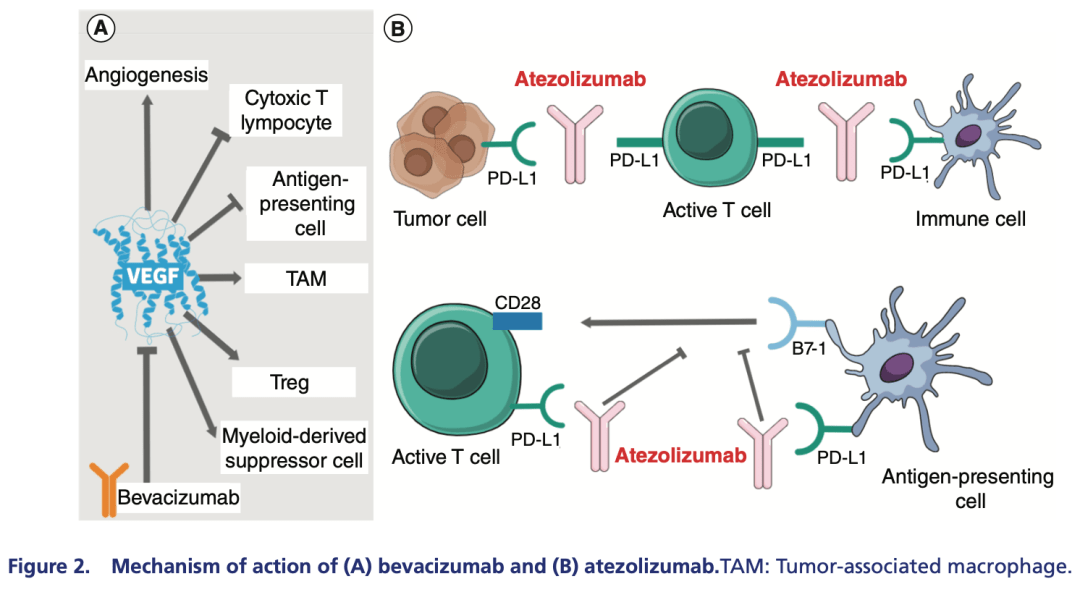
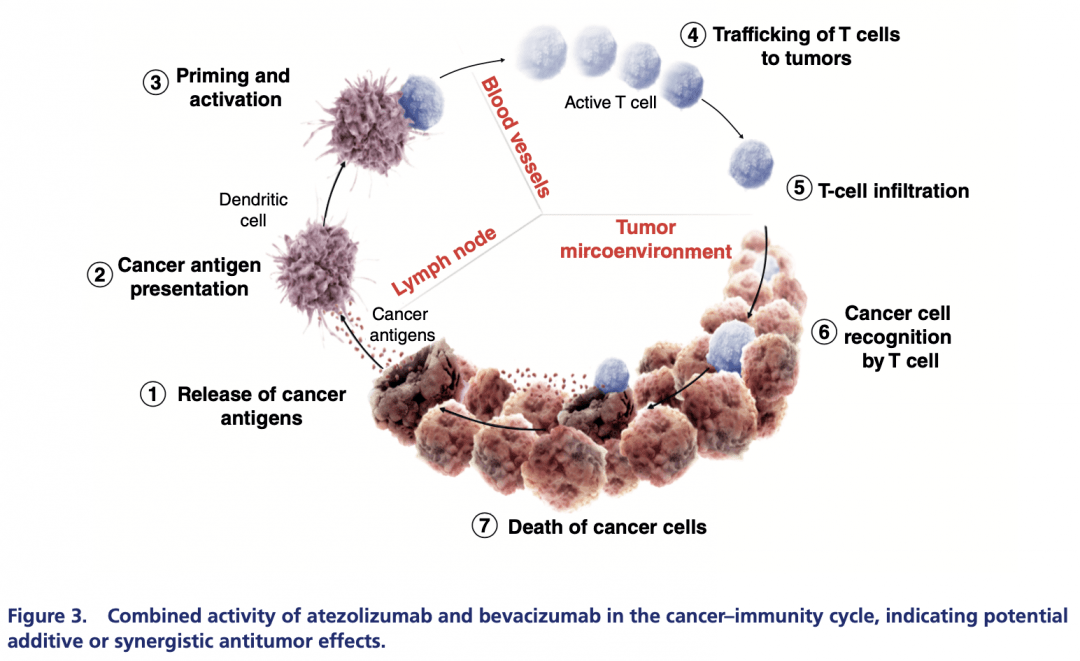
阿替利珠单抗是PD-L1抑制剂,可通过阻断PD-L1与其受体PD-1和B7-1(CD80)的结合,从而解除肿瘤免疫微环境抑制状态和T细胞耗竭,促进肿瘤特异性T细胞活化、增殖和杀伤效应,实现肿瘤细胞的清除。贝伐珠单抗是重组人源化IgG1单克隆抗体,通过与VEGF的结合,抑制后者与其受体的相互作用,继而阻断其生物学活性,影响血管的渗透性、增生以及内皮细胞迁移与存活,达到抑制肿瘤血管生成、生长以及转移的效果。 肝癌是高度血管化的实体肿瘤,微血管密度高,因此,血管生成是肝癌发展的关键因素。贝伐珠单抗不仅可发挥抗血管生成的作用,还可减少肿瘤及其微环境中VEGF介导的免疫抑制作用,从而促进肿瘤组织中T细胞的浸润,增强免疫治疗的疗效。VEGF信号传导和PD-L1等免疫检查点在免疫应答的不同阶段发挥作用,因此,两者的联合阻断具有累加或协同的抗肿瘤作用(图2和图3)。
图2.“T+A”的作用机制(引自发表文章)
图3.“T+A”在肿瘤免疫周期中的累加或协同抗肿瘤作用(引自发表文章) 更长生存,更优质量:“T+A”研究进展 回溯阿替利珠单抗和贝伐珠单抗在肝癌领域的探索,二者单药治疗均可使肿瘤缓解但客观缓解率(ORR)不足20%(Ib期研究中阿替利珠单抗17%,II期研究中贝伐珠单抗13%~14%)。然而,两者联合治疗初治、不可切除HCC的Ib期临床研究(GO30140)显示ORR达到了36%,截至12.4个月的中位随访时间,反应持续时间(DoR)仍未达到,中位无进展生存期(mPFS)为7.3个月。基于该研究结果,2018年7月美国食品药物管理局(FDA)授予“T+A”初始治疗晚期或转移性HCC突破性疗法。 随后,探索“T+A”对比索拉非尼一线治疗晚期不可切除HCC疗效和安全性的全球多中心III期IMbrave150临床研究结果发布,两大主要终点——总生存期(OS)和PFS都达到了具有统计学意义的改善。因此,FDA和中国国家药品监督管理局(NMPA)分别于2020年5月和10月批准了“T+A”方案治疗既往未接受过系统治疗的不可切除HCC患者的临床应用。 2021年1月召开的美国临床肿瘤学会胃肠道肿瘤研讨会(ASCO GI)上,IMbrave150研究更新了OS的最新数据。结果显示,在15.6个月的中位随访后,“T+A”可降低死亡风险34%,mOS达19.2个月,优于索拉非尼的13.4个月(HR=0.66,95% CI 0.52–0.85); 在中国亚组中,mOS更是高达24.0个月(索拉非尼组为11.4个月,HR=0.53,95% CI 0.35-0.80)。ORR与首次分析结果一致(30%),更多的患者实现了完全缓解(8%)。未发现任何新的安全信号。更新的数据再次证明了“T+A”一线治疗晚期HCC患者带来的持久生存获益。 此外,值得一提的是, IMbrave150研究创新性探索了“T+A”方案对患者报告结局(PRO)的影响。结果显示,“T+A”方案可显著提高患者的生活质量(QOL)、机体功能和角色功能,相较于索拉非尼,“T+A”方案可以延迟患者报告的QOL恶化时间(TTD)7.6 个月(中位TTD分别为11.2个月和3.6个月,HR 0.63,95% CI 0.46–0.85),机体功能TTD 时间8.2个月(中位TTD分别为13.1个月和4.9个月,HR 0.53,95% CI 0.39–0.73)和角色功能TTD时间5.5个月(中位TTD分别为9.1个月和3.6个月,HR 0.62,95% CI 0.46–0.84)。 更多探索,孰优孰劣:比较不同免疫联合治疗方案 多项临床研究显示,PD-1/PD-L1抑制剂联合抗血管生成或抗CTLA-4治疗HCC可获得更好的ORR和DoR,迄今尚没有头对头比较PD-1抑制剂和PD-L1抑制剂的临床研究,因此无法得知哪种联合治疗方案在HCC的治疗中更加优效。但近期一项荟萃分析表明 PD-L1抑制剂可能会降低免疫相关性肺炎的风险,在比较PD-1抑制剂与PD-L1抑制剂治疗非小细胞肺癌的随机对照临床试验结果后发现,PD-1抑制剂较PD-L1抑制剂显著增加所有等级的肺炎风险[3.6%(95% CI 2.4–4.9)对比1.3%(95% CI 0.8–1.9),P=0.001],这一风险尤其见于初治患者。 PD-1抑制剂与PD-L1抑制剂可能在作用方式上存在差异。前者可阻断PD-1与PD-L1、PD-L2的结合,但不影响PD-1与B7-1的抑制作用。PD-L1抑制剂可阻断PD-L1与PD-1、B7-1的结合,但无法抑制PD-1和PD-L2的结合。已有研究显示,治疗前具有较多树突细胞的患者更有可能对抗PD-L1治疗产生反应。PD-L1在各种组织类型中普遍表达,因此在维持免疫稳态方面发挥着关键作用。然而,PD-L2在抗肿瘤免疫方面的作用尚不清楚。 鉴于抗PD-1/抗PD-L1药物和抗血管生成药物是目前较为广泛的免疫联合方案探索用药,所以有必要对比抗血管生成多激酶抑制剂(MKI)与特定VEGF/VEGFR抑制剂的抗肿瘤机制和相对获益。VEGF信号通路是抗血管生成抑制剂发挥免疫调节作用的主要机制,联合阻断VEGF信号传导和免疫检查点具有协同的抗肿瘤作用。MKI与特定VEGF/VEGFR抑制剂在安全性上有所不同,例如索拉非尼对比贝伐珠单抗,前者手掌-足底红斑感觉异常不良反应(AE)发生率较高,而高血压和蛋白尿在后者使用中相对常见。但是,IMbrave150研究发现, 贝伐珠单抗和索拉非尼在导致3/4级出血——这一临床医生特别关注的AE的发生率方面相似(6.4%和5.8%),尽管试验包括了已患有食管静脉曲张的患者。 落地临床,展望未来:HCC的免疫治疗前景 当前,“T+A”方案已获批用于临床,在落地实践时如下四个层面的思考可为新疗法的应用提供参考:① 获益人群,IMbrave150研究显示,甲胎蛋白(AFP)可能是潜在的治疗获益生物标志物,基线AFP≥20 ng/ml、接受“T+A”治疗的患者,在治疗6周后,AFP水平下降≥75%或升高≤10%与OS和PFS的改善显著相关(HR<0.5,P<0.05)。② 安全性,“T+A”方案可耐受,且毒性可控。③ 用药剂量,较高剂量的贝伐珠单抗可带来更好的疗效,且安全性良好。④ HBV感染的潜在影响,乙型肝炎病毒(HBV)感染至少占全球HCC病例的50%,且HBV相关HCC患者的预后普遍较差,然而IMbrave150研究的亚组分析发现,HBV相关HCC亚组人群的疗效、PRO和安全性结果与全球人群一致。 值得注意的是,未来“T+A”疗法将形成更为成熟的数据,尤其是来自真实世界的数据。随着临床更多患者人群使用“T+A”这一联合治疗方案,临床医生可逐步探索其落地实践的疗效和安全性。与此同时,值得深入研究“T+A”方案在更广泛或特定患者人群的应用,例如Child–Pugh B级肝硬化的HCC患者,HBV高负荷HCC患者,同时感染HBV、HCV、HIV的HCC患者等。此外,“T+A”联合消融或经动脉化学栓塞术(TACE)等局部治疗、“T+A”联合治疗后疾病进展后线治疗选择等临床研究较具前景,且已经在如火如荼地开展中。 小结 “T+A”联合治疗方案开启了晚期HCC免疫联合治疗新时代,IMbrave150研究证实了这一联合治疗方案相比传统治疗可为患者带来更长的生存期和更优的生活质量。随着更多免疫联合系统或局部治疗研究的深耕前行,临床医生对各种治疗方案的认知将得到进一步加深,从而为患者制定出最佳的治疗策略,改善HCC患者的预后。 参考文献: Liu, Xiufeng et al. “Atezolizumab and bevacizumab for hepatocellular carcinoma: mechanism, pharmacokinetics and future treatment strategies.” Future oncology(2021): n. pag.返回搜狐,查看更多 |
【本文地址】