| 君赛生物首款TIL细胞新药获得NMPA临床试验默示许可 | 您所在的位置:网站首页 › NMPA临床试验默示许可 › 君赛生物首款TIL细胞新药获得NMPA临床试验默示许可 |
君赛生物首款TIL细胞新药获得NMPA临床试验默示许可
|
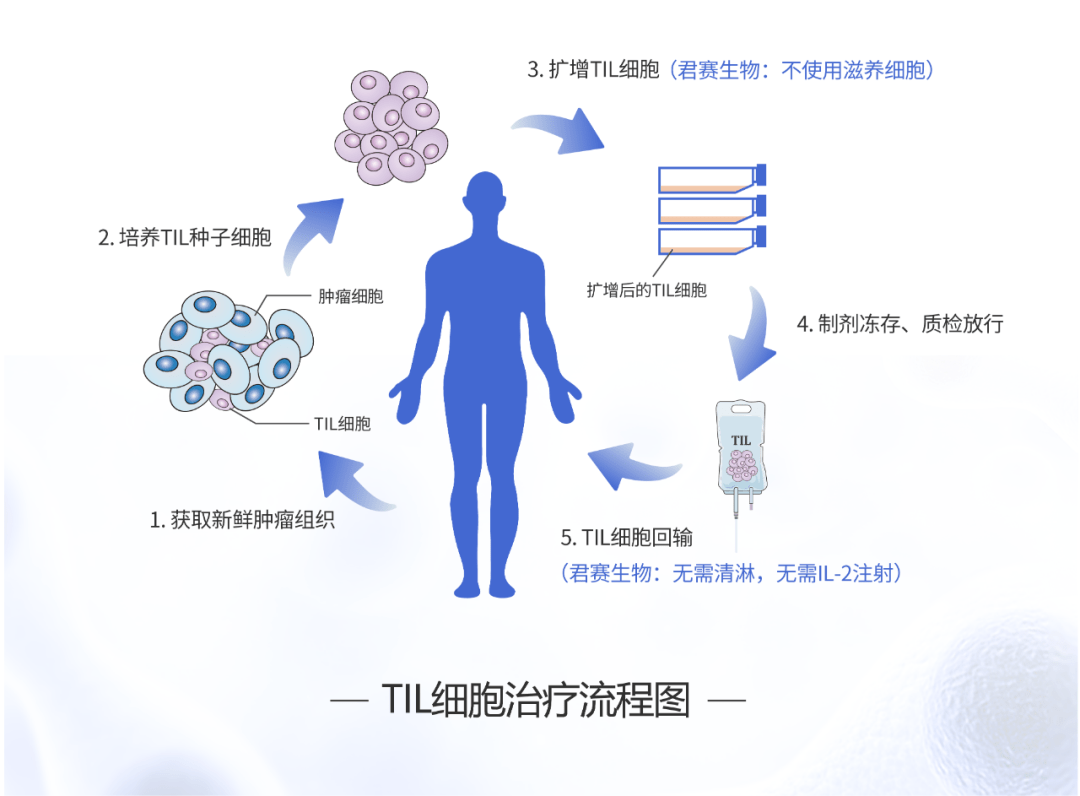
同时,以Iovance公司为代表的传统TIL细胞疗法,细胞体外规模扩增依赖异源滋养细胞;TIL细胞回输前必需非清髓性清淋预处理,回输后必需大剂量IL-2的反复注射,工艺较复杂、临床局限性较大。
君赛生物已建成高标准的GMP级生产车间与质控实验室,自主开发建立标准化的TIL细胞制备工艺与配套质量管理体系。同时,面向临床方案的简化,建立原创的TIL细胞培养专利技术体系,在省略异源滋养细胞的前提下,TIL细胞数量达到百亿级,且以记忆性细胞为主体,不同瘤种TIL培养成功率>90%。 临床方案方面,在TIL细胞回输前,无需清淋性预处理;细胞回输后无需IL-2的注射,即可实现TIL细胞在体内有效增殖。患者可在普通病房里接受治疗,大大提高TIL细胞疗法的安全性与可及性,显著降低相关临床费用。
GC101是君赛生物的首款TIL细胞新药品种,在前期研究者发起的临床研究(IIT)中,展现良好的安全性与有效性。2例受试者达到完全缓解(CR)疗效,3例受试者达到部分缓解(PR)疗效,CR持续时间已分别超过8个月与6个月,代表性临床结果发表在国际知名癌症免疫治疗杂志Journal for ImmunoTherapy of Cancer。
✦ 关于君赛生物 ✦ 上海君赛生物科技有限公司成立于2019年,专业致力于基因-细胞创新疗法的开发,已通过国家级高新技术企业资质认定。公司自主建立全球领先的创新型天然TIL细胞与基于非病毒载体基因修饰TIL细胞产品管线,核心技术已布局国际PCT与中国发明专利,获得多项上海市科委、发改委专项课题资助。
公司拥有一支国际化的、专业的细胞新药开发与临床团队,核心成员均具有细胞新药的成功开发经验,正在全国知名三甲医院合作开展9项NCT注册的TIL细胞临床研究。公司拥有2000平方米的GMP级生产车间与质控实验室,可满足不同管线的并行开发。已完成三轮融资,融资额近2.5亿元,现有投资方包括元禾原点、复容、凯泰、幂方、怀格、朗姿韩亚、黄埔医药、华医、元生创投等知名生物医药基金。返回搜狐,查看更多 |
【本文地址】
| 今日新闻 |
| 推荐新闻 |
| 专题文章 |