| 辣椒bHLH转录因子家族的全基因组鉴定:发现了一个参与物种特异性生物活性代谢物 | 您所在的位置:网站首页 › ACR蛋白有BHLH结构域吗 › 辣椒bHLH转录因子家族的全基因组鉴定:发现了一个参与物种特异性生物活性代谢物 |
辣椒bHLH转录因子家族的全基因组鉴定:发现了一个参与物种特异性生物活性代谢物
|
鉴定和染色体定位bHLHs公司在胡椒里
排除冗余序列后,共鉴定出107个bHLH蛋白C一年生植物利用隐马尔可夫模型(HMM)分析HLH结构域(PF00010)。如表所示S1,均鉴定出CabHLH蛋白编码190-940个氨基酸残基。这些蛋白的分子量(Mw)在21.61 ~ 106.70 kDa之间,理论pI在4.60 ~ 9.91之间。 107.CabHLHs被更名为CABHLH001来CabHLH107并根据染色体位置将其映射到辣椒染色体上(图S2). 它们分布在12条染色体上。01号染色体含有最多的Cabhlh.会员(18)。染色体05和09包括三个Cabhlh.成员,分别。然而,基因来自CABHLH092来CabHLH107没有位于任何染色体上。由于测序和组装技术限制,位于某些支架中的基因未组装成染色体。 BHLH结构域的保守氨基酸残基BHLH结构域的氨基酸序列用于进行多个对准分析(图S3).结果表明,BHLH家族蛋白具有保守的BHLH域,其中包含基本,第一螺旋,环路和第二螺旋区域。如图1所示。1,将20个氨基酸残基保守,共有比例大于50%,并且在保守的BHLH结构域中的共有比75%的共有比例保守了六个氨基酸残基。在基本地区保存了五个残基(他-5,Glu-9,Arg-10,Arg-12)。在第一个螺旋地区保存了四个残基(Leu-23,Leu-26,Val-27和Pro-28)。Lys-31和Asp-34在环形区域和九个残基(Lys-35,Ala-36,Ser-37,Leu-39,Ala-42,Ile-43,Tyr-45,Leu-49和Leu-49和Leu-56)在第二个螺旋地区保守。辣椒中107个BHLH蛋白质中的残留物Leu-23和Leu-49极为保守。 图。1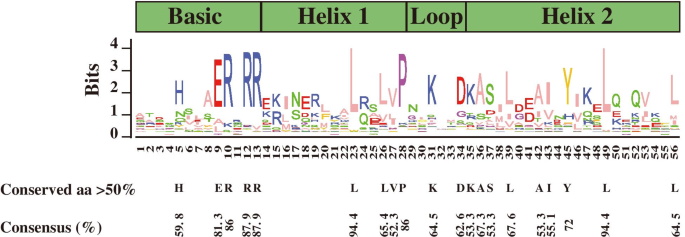
辣椒中BHLH结构域的保守氨基酸分析。氨基酸的高度表示在所有识别的BHLH蛋白中观察到的频率。黑色字母代表了高度保守的氨基酸,其共有比例大于50% 全尺寸图像 BHLH家族蛋白的系统发育分析为了对CabHLH蛋白进行分类,建立了一棵系统发育树,该树包含了辣椒中所有已鉴定的bHLH蛋白序列拟南芥用邻近加入方法构建(图。2).根据前一项研究中的Atbhlhs的分类[21], CabHLH蛋白分为15个亚家族,命名为I ~ XII族。组II中CabHLH蛋白最多(25个),AtbHLHs蛋白最多(13个),而组VII中CabHLH蛋白最多(1个),AtbHLH蛋白最多(3个)。同一类群中CabHLHs和AtbHLHs蛋白数量的不同,可能是由于在植物进化过程中bHLH家族的复制不均等造成的。 图2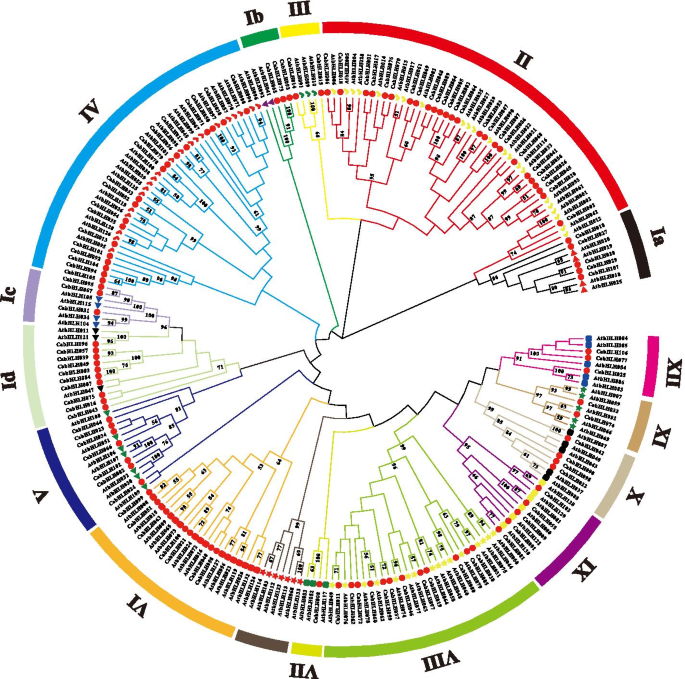
研究了bHLH家族成员的系统发育树辣椒和拟南芥.不同颜色的分支表示不同的子组。红色圆圈代表了cabhlh蛋白。不同的颜色和形状代表了先前研究中鉴定的不同的atbhlh蛋白组[21]. 棕色的分支表明没有CabHLH蛋白 全尺寸图像同一群体的成员可能具有相似的生物学功能。为了对CabHLHs的生物学功能进行初步推测,我们利用中所有bHLH蛋白构建了另一种邻域连接系统发生树拟南芥,西红柿,米饭和胡椒(图S4).AtbHLHs和SlbHLHs的功能特征已在文献中报道和总结,并将这些功能特征用于评价同一组CabHLH的潜在功能(TableS2). 第六组SlPIF1a对番茄类胡萝卜素的合成具有光依赖性调控作用[38]. SlPIF1a映射到CABHLH051在辣椒,也被分为六世组。这些结果表明,VI组的成员可能参与类胡萝卜素生物合成。 CABHLH蛋白保守基序分析为了研究CabHLH蛋白的结构特征,我们使用多重EM for Motif Elicitation (MEME)组件对其保守的氨基酸基序进行了分析和鉴定。motif 1 ~ 15共发现15个包含21 ~ 100个残基的保守motif。主题信息见表S3. 基序1和基序2位于bHLH结构域区域,出现在所有蛋白质中。基序3~15分布于bHLH结构域外。基序6、7、8和11主要局限于第二组。第四组中有9、12和15个基序,第二组中有10和13个基序,第五组中有14个基序。一般来说,同一组的大多数蛋白质在排列和位置上具有共同的基序(图。3.). 图3.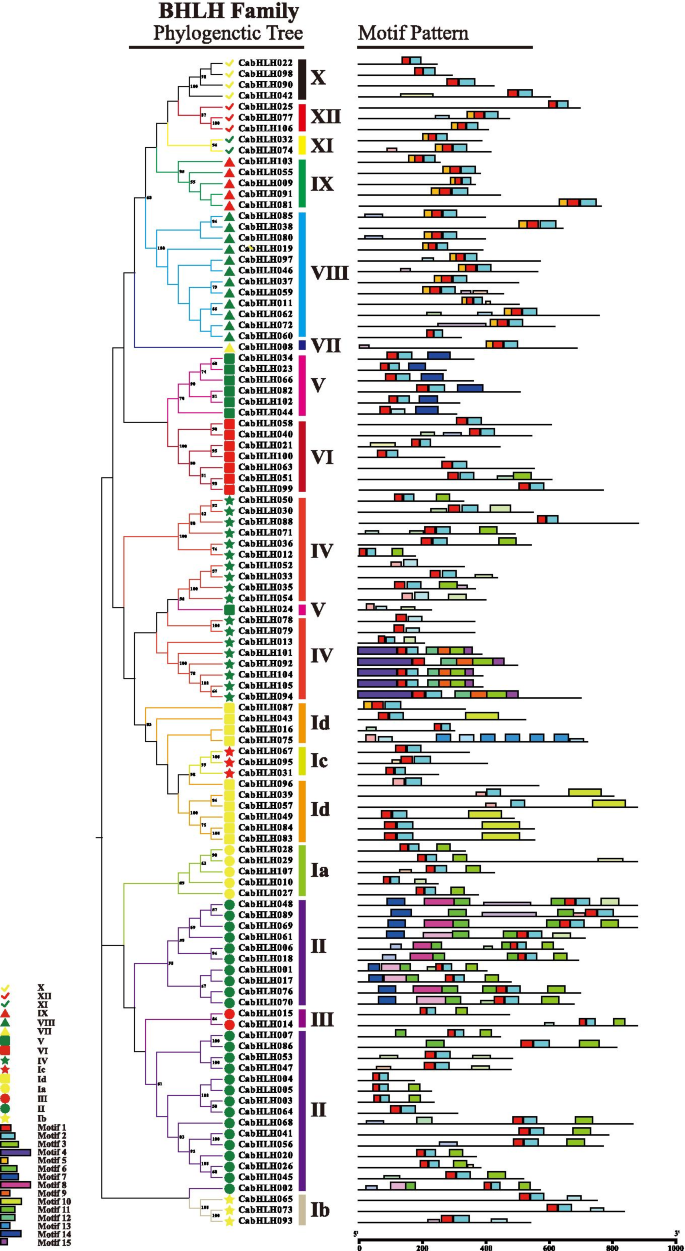
Cabhlh蛋白的系统发育树和保守的主题分布。邻近的系统发育树用Mega-x构建。不同的彩色盒子代表不同的主题。盒子长度代表主题长度。不同颜色的形状表示Cabhlhs的系统发育树中的不同组 全尺寸图像 的表达谱CabHLHs在果皮和胎盘的不同发育阶段辣椒果实中含有辣椒素和辣椒素,与发育阶段生物合成基因的转录水平密切相关。为了进一步了解CabHLHs在辣椒素和辣椒素生物合成过程中的潜在功能,研究了CabHLHs的表达谱CabHLHs在不同的发育中,研究了Pericarp和胎盘。从Kim等人获得RNA-SEQ原始数据。[52[3,16,25,36,38,43和48天,后波动后(DPA)阶段(图。4.和5.). 所有原始读取都被拼接并重新映射到C一年生植物基因组。 图4.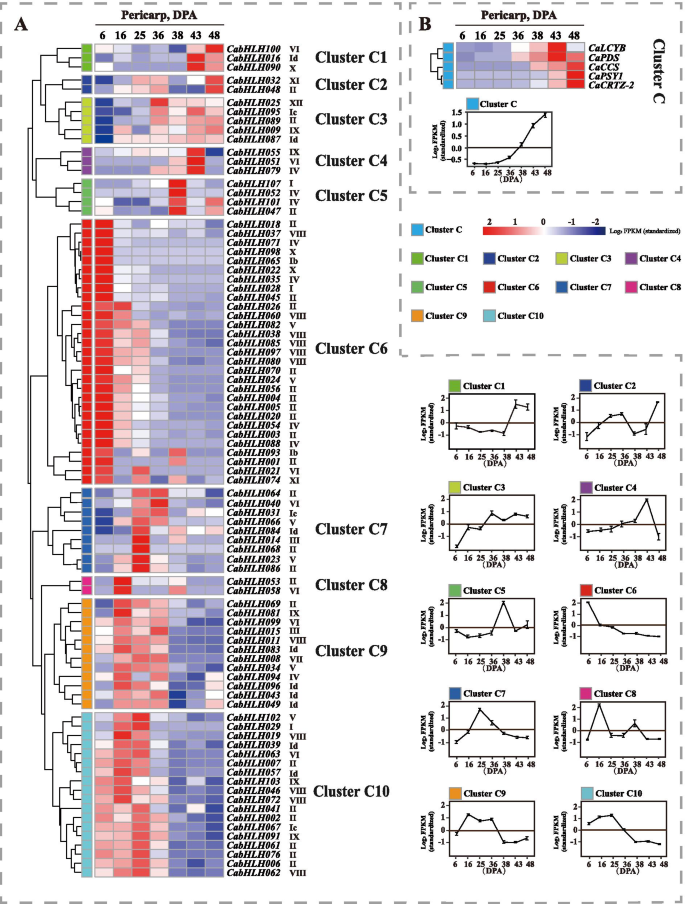
基因在果皮不同发育阶段的表达谱。一种.的表达谱Cabhlh.果皮不同发育阶段的基因。B..capsorubin生物合成基因在果皮不同发育阶段的表达谱。在热图的右侧包括每个基因的名称和系统发生群的短名称。基于层次聚类分析,以每百万个片段中每千碱基外显子的Log2值(FPKM)构建热图。使用整个聚类的平均值生成折线图。C簇中的字母“C”表示果皮 全尺寸图像 图5.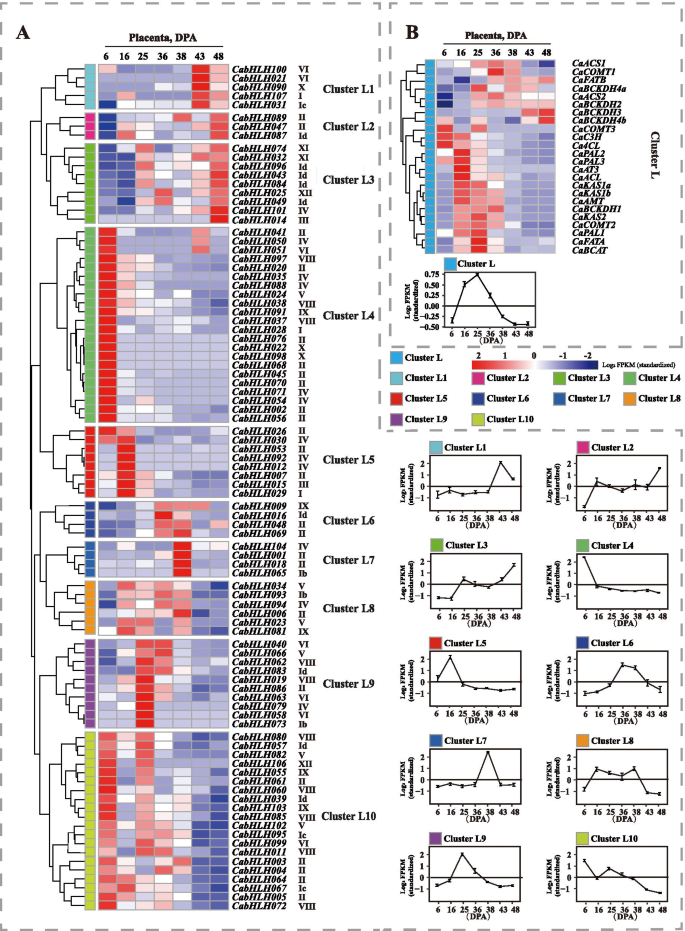
胎盘不同发育阶段基因的表达谱。一种.的表达谱Cabhlh.胎盘不同发育阶段的基因。B..胎盘不同发育阶段胶囊化生物合成基因的表达谱。每个基因的名称和系统发育组的短名称出现在热图的右侧。Rog2 FPKM值用于构建具有分层聚类分析的热图。使用整个群集的平均值来编写线图。集群L中的字母“L”表示胎盘 全尺寸图像如图1所示。4.B,胶囊素生物合成基因的表达水平在36dPa逐渐增加,这与钙霉素组织中辣椒素的累积曲线一致。共有20个表达Cabhlh.基因检测不到。这些基因可能在果皮发育的不同阶段转录水平较低。根据表达谱的相似性,所有Cabhlh.不同发育终端阶段的表达分布在分层聚集并分为10个簇(图。4.a) 是的。表达谱CabHLHs在簇C1至C4中,与辣椒素生物合成基因的表达谱保持良好的一致性。簇C1至C4的成员可能与辣椒素生物合成相关。 在胎盘的发育阶段中,辣椒素含量从13至25dPa大量产生,并且在该阶段期间辣椒化合物生物合成基因的表达水平高(图。5.b)。基于表达谱的相似性,将不同发育胎盘阶段的所有CABHLH的表达分层聚集成10个簇(图。5.a) 是的。在无法检测到的低水平中表达了总共16个基因。表达概况CabHLHs簇L5、L6、L8和L9与辣椒素生物合成基因的表达谱相似。因此,这些结果表明簇L5、L6、L8和L9的成员可能与辣椒素的生物合成有关。 此外,辣椒素和辣椒素主要产生于辣椒的果皮和胎盘组织。确认是否CabHLHs在果皮和胎盘组织中特异性表达,研究了所有已鉴定的CabHLHs在不同组织(包括叶、根、茎、果皮和胎盘)中的表达谱。然而,Kim等人上传的RNA-Seq原始数据并不包含辣椒的叶、根或茎组织[52].这些组织的RPKM值,映射到1.5版C一年生植物基因组,直接在线发表。热图表示CabHLHs在某些组织中没有特别表达(图S5).据推测,除调节胶囊素和辣椒素生物合成外,这些TFS策划了功能。 参与胶囊素和辣椒化合物生物合成的候选BHLH基因的验证的表达式配置文件进一步验证CabHLHs在果皮和胎盘中,有10个CabHLHs从可能与辣椒素和辣椒碱生物合成相关的候选簇进行QRT-PCR分析。所选基因在不同的发育果皮或胎盘组织中相对高度表达。如图1所示。6.a,玉米蛋白和胶囊素的含量从果皮组织中的mg阶段增加,而非合成胶囊素分支的叶黄素含量降低。在不同的发育终端组织中未注意到β-胡萝卜素含量的显着差异。卡布勒H032那CABHLH048那CABHLH095和CabHLH100类胡萝卜素(玉米黄质和capsorubin)在果皮中的表达与积累谱一致CABHLH009叶黄素在果皮中的表达与积累规律相似。然而,这些基因在其他组织(根、花、茎、胎盘、叶和种子)中也有高表达。6.b) 是的。因此,C1、C2和C3簇的成员很可能与capsorubin生物合成有关,但在其他组织中也具有其他特定功能。 图6.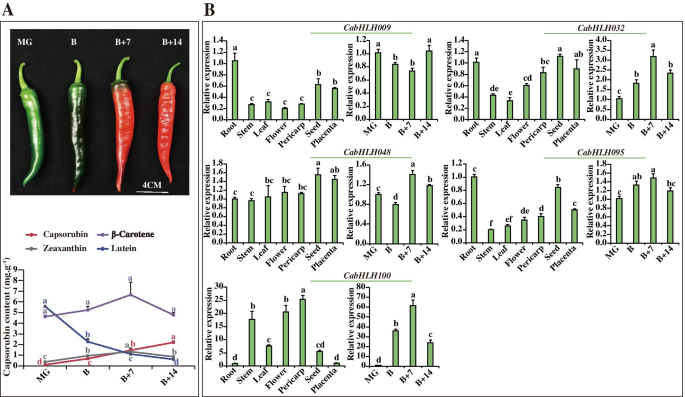
5种表达谱CabHLHs在不同的组织和果皮的发育阶段。一种.β-胡萝卜素、玉米黄质的表型及含量。果皮发育的四个阶段,即成熟绿期(MG)、破碎期(B)、破碎加7d期(B + 7)和破碎加14d期(B + 14) [34].B..五个表达CabHLHs不同组织(茎、根、种子、花、叶、果皮(B)和胎座(16 DPA))和4个不同的果皮阶段。数字中不同的字母表示显著不同的数值(P. 全尺寸图像辣椒素和二氢胶囊最初在10dPa下产生,在胎盘组织中达到25dPa,然后逐渐降低(图。7.a) 是的。CABHLH007那CABHLH009那CabHLH026型那CABHLH063和CABHLH086辣椒素在胎盘不同发育阶段的表达与积累谱相似。的高表达水平CabHLH026型在果皮、种子和胎盘组织中均有高表达CABHLH063在茎和叶中很明显。CABHLH007那CABHLH009和CABHLH086在某些组织中高度表达(图。7.b)。所以,CABHLH007那CABHLH009那CabHLH026型那CABHLH063和CABHLH086L5、L6和L9可能与辣椒素的生物合成有关。 图7.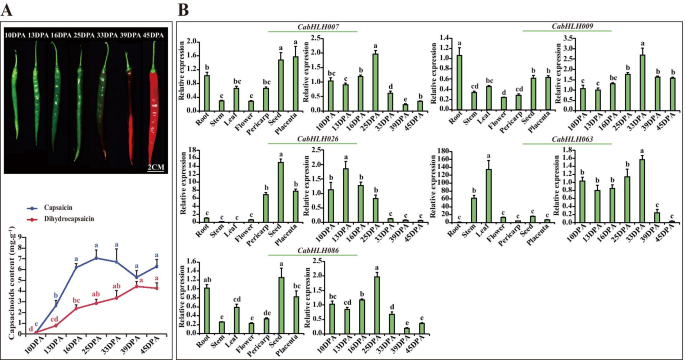
表达五CabHLHs在不同的组织和不同的发育胎盘阶段。一种.7个胎盘发育阶段(DPA 10、13、16、25、33、39、45)的表型(上升)和辣椒素、二氢辣椒素含量(下降)[34].B..五个表达CabHLHs在不同的组织中(根,茎,叶,花,种子,胎盘(16dPa)和Pericarp(16dPa))和七种不同的发育胎盘阶段。图中不同的小写字母表示值显着不同(P. 全尺寸图像 候选人的表达CabHLHs与辣椒化合物生物合成相关,响应于不同的温度初步了解辣椒素生物合成是否受到监管Cabhlh.基因响应不同的温度,五个候选人的表达CabHLHs并测量不同温度下的五种重要胶囊化生物合成基因。如图1所示。8.A,辣椒素和二氢淀粉蛋白含量随着从T15至T25的升高而增加而增加。与T33治疗的辣椒相比,胎盘衣膜蛋白含量显着增加。CABHLH007那CABHLH009和CABHLH086表达随着温度的增加而增加,其类似于二氢普苷的积累(图。8.b)。CabHLH026型在T25高表达,这与辣椒素的积累和辣椒素类生物合成基因的表达一致(AT3那AMT那BCKDH和KasIa)(图。8.Bc) 是的。相反,CABHLH063表达随着温度的增加而降低,与胶囊化生物合成基因的表达谱保持一致ACL.(图。8.B;C)。因此,CABHLH007那CABHLH009和CABHLH086表达与二氢辣椒素含量和温度的增加呈正相关。CABHLH063表达与辣椒素含量和温度的增加呈负相关,而CabHLH026型表达与这些因素呈正相关。这些候选基因可能通过调节胶囊化生物合成基因的转录来响应不同温度的辣椒素生物合成。 图8.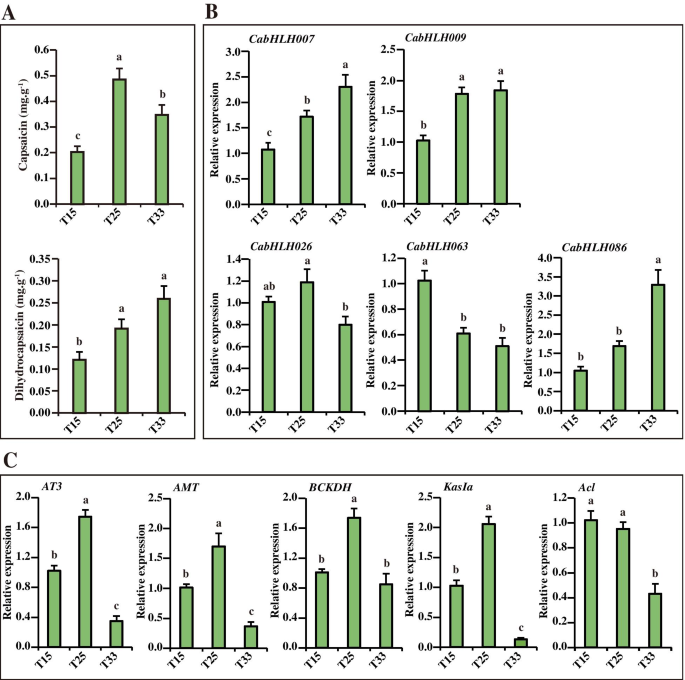
辣椒素含量(辣椒素和二氢胶囊)和基因表达响应于不同的温度。一种.辣椒素和二氢皮淀蛋白响应不同温度的含量[34].B..五个表达Cabhlh.S响应于不同的温度。C.胶囊化生物合成基因对不同温度的表达。图中不同的小写字母表示值显着不同(P. 全尺寸图像 候选CABHLHS和MYB31在酵母中的相互作用,鉴定的BHLH结合位点bHLH蛋白通常与基因启动子的E-box结合位点结合并调控转录。为了研究bHLH转录因子与途径生物合成基因的潜在关联,我们选取了capsorubin和辣椒素生物合成基因起始密码子(ATG)上游的1500个碱基对核苷酸序列,包括CCS那ps那β-CH.那β-lcy.那ACL.那AMT那AT3那Bact,Bckdh.那COMTA.那法塔和KasIa使用PlantCARE数据库进行分析[55].如表所示S7,除了用于的胶囊素和辣椒素生物合成基因的启动子中,检测到多个BHLH DNA结合位点,除了CCS那β-CH.和KasIa. BHLH蛋白始终通过与其他TFS交互来执行功能,例如MYB。我们执行了Y2H测定以验证候选CABHLHS和CAMYB31之间的相互作用。结果表明,这些BHLH以基因依赖性方式与MyB31相互作用。CABHLH007,CABHLH009,CABHLH026,CABHLH063和CABHLH086可以在异源系统中与MYB31相互作用。CABHLH026在酵母中强烈相互作用,而仅在CABHLH063-CAMYB31和CABHLH086-CAMYB31组中观察到弱相互作用(图。9.).因此,CabHLH可能通过与CaMYB31相互作用来调控辣椒素的生物合成。 图9.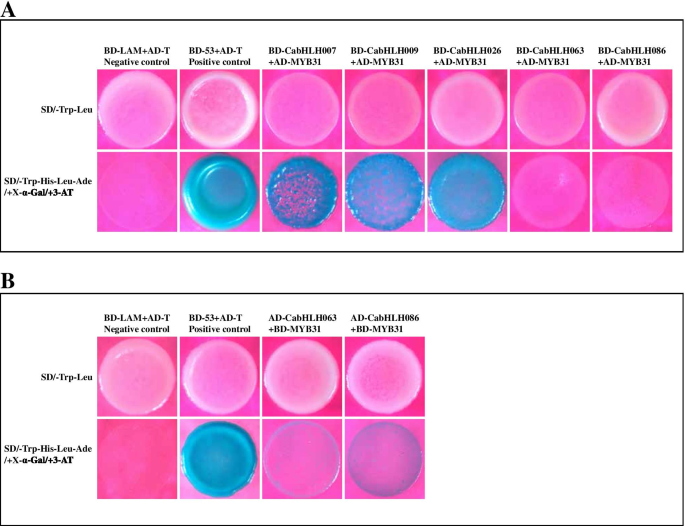
酵母双杂交测定的蛋白质相互作用与CamyB31之间的蛋白质相互作用。一种.CABHLHS和CAMYB31与CABYB31之间的蛋白质 - 蛋白质相互作用的酵母双杂化分析。B..CabHLHs与CaMYB31之间蛋白质-蛋白质相互作用的逆向酵母双杂交分析。AD和BD表示空的pGADT7和pGBKT7载体。合成葡萄糖(SD)培养基缺少色氨酸和亮氨酸;SD/-Trp-His-Leu-Ade培养基缺乏色氨酸、组氨酸、亮氨酸和腺嘌呤 全尺寸图像 |
【本文地址】